Campata
La Información De Este Sitio No Constituye Asesoramiento Médico. No Vendemos Nada. No Se Garantiza La Precisión De La Traducción. Descargo De Responsabilidad
Resumen de drogas
¿Qué es Campath?
Campath (alemtuzumab) es un anticuerpo hecho de ADN animal utilizado para tratar la leucemia linfocítica crónica. Campath generalmente se administra después de que otros medicamentos hayan sido juzgados sin un tratamiento exitoso.
¿Qué son los efectos secundarios de Campath?
Campath puede causar efectos secundarios graves que incluyen:
- urticaria
- Dificultad para respirar
- hinchazón de tu cara labios lengua o garganta
- fiebre
- escalofríos
- náuseas
- mareal
- erupción
- sibilante
- dolor en el pecho
- Problemas con la visión del pensamiento del habla o el movimiento muscular
- Hemorizas fáciles
- sangrado inusual
- manchas moradas o rojas debajo de tu piel
- llagas en la boca
- llagas de la piel
- dolor de garganta
- tos
- piel pálida o amarillenta
- orina de color oscuro
- confusión
- debilidad inusual
- dificultad para respirar
- manos frías y pies
- hinchazón en la parte inferior de las piernas
- aumento de peso
- pérdida de apetito
- dolor repentino en el estómago o la espalda y
- orina que se ve rosa marrón o espuma
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas enumerados anteriormente.
Los efectos secundarios comunes del campath incluyen:
- fiebre
- escalofríos
- mareo
- rigidez muscular
- dolor articular o muscular
- náuseas
- vómitos
- pérdida de apetito
- dolor abdominal
- dolor de cabeza
- diarrea
- erupción or itching
- urticaria
- cansancio
- Problemas de sueño (insomnio)
- ansiedad
- fatiga
- tos
- sudoración o
- problemas para respirar durante o después de la infusión.
Estos efectos secundarios ocurren con mayor frecuencia durante la primera semana de tratamiento con Campath. Dígale a su médico si tiene efectos secundarios graves de Campath, incluyendo:
- dificultad para respirar
- Cambios mentales/de humor (como la ansiedad por la depresión)
- hueso o dolor de espalda
- espasmo muscular
- debilidad inusual
- tobillos o pies de hinchazón
- piel o ojos amarillentos
- cambios en la cantidad de orina
- orina dolorosa
- orina rosa o sangrienta
- entumecimiento o hormigueo de brazos o piernas o
- dolor/enrojecimiento/hinchazón de brazos/piernas/sitio de inyección.
Busque atención médica o llame al 911 a la vez si tiene los siguientes efectos secundarios graves:
- Síntomas oculares graves, como la pérdida de visión repentina, la visión borrosa de la visión del túnel dolor o hinchazón o ver halos alrededor de las luces;
- Síntomas cardíacos graves como latidos irregulares rápidos o laterales; revoloteando en tu pecho; dificultad para respirar; y mareos repentinos aturdidos o desmayos;
- La confusión de dolor de cabeza severo arrastró el brazo del habla o la debilidad de la pierna, problemas para caminar la pérdida de la coordinación que se siente inestable músculos muy rígidos, fiebre alta sudoración o temblores.
Este documento no contiene todos los efectos secundarios posibles y otros pueden ocurrir. Consulte con su médico para obtener información adicional sobre los efectos secundarios.
Dosis para campath
La medicación Campath se administra por vía intravenosa bajo la supervisión del médico, generalmente durante 2 horas. La dosis se basa en la respuesta del paciente al tratamiento. Los pacientes generalmente comienzan con una dosis baja del medicamento y la dosis puede aumentar lentamente.
¿Qué sustancias o suplementos de drogas interactúan con Campath?
Otras drogas pueden afectar el campamento. Cuéntale a su médico sobre todos los medicamentos recetados y de venta libre que usa. Esto incluye vitaminas minerales productos herbales y medicamentos recetados por otros médicos. No comience a usar un nuevo medicamento sin decirle a su médico.
Efectos secundarios de Augmentin en niños pequeños
Campath durante el embarazo y la lactancia materna
Durante el embarazo, el campamento debe usarse solo cuando se lo prescribe. Se recomienda que los hombres y las mujeres que reciban este medicamento usan al menos 2 formas de control de la natalidad (por ejemplo, píldoras anticonceptivas de condones) durante el tratamiento con este medicamento y durante al menos 6 meses después. No se sabe si esta droga pasa a la leche materna. Debido al posible riesgo para la lactancia materna, al usar este medicamento, no se recomienda durante el tratamiento con este medicamento y durante al menos 3 meses después.
información adicional
Nuestro centro de medicamentos de efectos secundarios de Campath (Alemtuzumab) proporciona una visión integral de la información de drogas disponible sobre los posibles efectos secundarios al tomar este medicamento.
Información de drogas de la FDA
- Descripción de drogas
- Indicación
- Efectos secundarios
- Advertencias
- Sobredosis
- Farmacología clínica
- Guía de medicación
ADVERTENCIA
Reacciones e infecciones de infusión de citopenias
Citopenias
Severo, incluida la pancitopenia fatal/hipoplasia de médula, la trombocitopenia idiopática autoinmune y la anemia hemolítica autoinmune pueden ocurrir en pacientes que reciben campath. Las dosis individuales de campatinas superiores a 30 mg o dosis acumulativas superiores a 90 mg por semana aumentan la incidencia de pancitopenia [ver advertencias y PRECAUCIONES ]
Reacciones de infusión
La administración de Campath puede dar como resultado serios, incluidas las reacciones de infusión fatal. Controle cuidadosamente a los pacientes durante las infusiones y retenga Campath para las reacciones de infusión de grado 3 o 4. Gradualmente aumenta el campath a la dosis recomendada al inicio de la terapia y después de la interrupción de la terapia durante 7 o más días [ver Dosis y administración y advertencias y PRECAUCIONES ]
Infecciones
Se puede producir infecciones fúngicas fatales fúngicas bacterianas virales y protozoos en pacientes que reciben campath. Administrar profilaxis contra Pneumocystis jiroveci neumonía (PCP) e infecciones por virus del herpes [ver Dosis y administración y advertencias y PRECAUCIONES ]
Descripción para el campamento
Campath (alemtuzumab) es un anticuerpo monoclonal humanizado derivado del ADN recombinante (Campath-1H) dirigido contra la glucoproteína de la superficie celular de 21–28 kD CD52. CAMPATH-1H es un anticuerpo IgG1 kappa con marco variable humano y regiones constantes y regiones de complementarios que dederminan un anticuerpo monoclonal murino (rata) (Campath-1g). El anticuerpo Campath-1H tiene un peso molecular aproximado de 150 kD. Campath se produce en cultivo de suspensión de células de mamíferos (ovario de hámster chino) en un medio que contiene neomicina. La neomicina no es detectable en el producto final.
Campath es una solución isotónica incolora estéril (pH 6.8–7.4) para la inyección. Cada vial de uso de un solo uso contiene 30 mg de alemtuzumab 8.0 mg de cloruro de sodio 1.44 mg fosfato de sodio dibásico 0.2 mg de cloruro de potasio 0.2 mg fosfato de potasio monobásico 0.1 mg de polisorbato 80 y 0.0187 mg de dihidrato de disodio. No se agregan conservantes.
Usos para el campamento
Campath se indica como un solo agente para el tratamiento de la leucemia linfocítica crónica de células B (B-CLL).
Dosis para campath
Programa de dosificación y administración
- Administrar como una infusión intravenosa durante 2 horas. No administre como empuje intravenoso o bolo.
- Régimen de dosificación recomendado
- Gradualmente se intensifica a la dosis única máxima recomendada de 30 mg. Se requiere una escalada al inicio de la dosificación o si la dosificación se mantiene ≥7 días durante el tratamiento. La escalada a 30 mg normalmente se puede lograr en 3 a 7 días.
- Estrategia de escalada
- Administrar 3 mg diariamente hasta que las reacciones relacionadas con la infusión son ≤ grado 2 [ver Reacciones adversas ]
- Luego, administre 10 mg diariamente hasta que las reacciones relacionadas con la infusión son ≤ Grado 2.
- Luego administre 30 mg/día tres veces por semana en días alternativos (por ejemplo, lunes-casco). La duración total de la terapia, incluida la escalada de dosis, es de 12 semanas.
- Las dosis individuales de más de 30 mg o dosis acumulativas superiores a 90 mg por semana aumentan la incidencia de pancitopenia.
Medicamentos concomitantes recomendados
- Pregedarse con difenhidramina (50 mg) y acetaminofeno (500-1000 mg) 30 minutos antes de la primera infusión y cada escalada de dosis. Instituto de gestión médica apropiada (por ejemplo, glucocorticoides epinefrina meperidina) para reacciones relacionadas con la infusión según sea necesario [ver ADVERTENCIAS AND PRECAUCIONES y Reacciones adversas ]
- Administre la doble resistencia de trimetoprima/sulfametoxazol (DS) dos veces al día 3 veces por semana (o equivalente) como profilaxis de neumonía (PCP) de neumocystis jirovecii (PCP).
- Administrar Famciclovir 250 mg de oferta o equivalente como profilaxis herpética.
Continuar con la profilaxis viral de PCP y herpes durante un mínimo de 2 meses después de la finalización de la campatía o hasta que el recuento de CD4 sea ≥200 células/μl, lo que ocurra más adelante [ver más adelante [ver más adelante [ver ADVERTENCIAS AND PRECAUCIONES ]
Modificación de dosis
- Retener a Campath durante una infección grave u otras reacciones adversas graves hasta la resolución.
- Deseche Campath para anemia autoinmune o trombocitopenia autoinmune.
- No se recomiendan modificaciones de dosis para la linfopenia.
Modificación de la dosis para neutropenia o trombocitopenia [ver advertencias y precauciones]
| Valores hematológicos | Modificación de dosis* |
| Congreso Nacional Africano <250/μL y/or platelet count ≤25000/μL | |
| Para la primera ocurrencia: | Retener la terapia Campath. Reanude la campatía a 30 mg cuando ANC ≥500/μL y el recuento de plaquetas ≥50000/μL. |
| Para el segundo ocurrencia: | Retener la terapia Campath. Reanude la campatía a 10 mg cuando ANC ≥500/μL y el recuento de plaquetas ≥50000/μL. |
| Para el tercer ocurrencia: | Discontinuar la terapia para campath. |
| > 50% de disminución de la línea de base en pacientes que inician la terapia con un ANC basal ≤250/μL y/o un recuento de plaquetas de línea de base ≤25000/μL | |
| Para la primera ocurrencia: | Retener la terapia Campath. Reanude el campamento a 30 mg al regresar al valor (s) basal (s). |
| Para el segundo ocurrencia: | Retener la terapia Campath. Reanudar Campath a 10 mg al regresar al valor (s) basal (s). |
| Para el tercer ocurrencia: | Discontinuar la terapia para campath. |
| * Si el retraso entre la dosificación es ≥7 días iniciar la terapia en Campath 3 mg y se intensifica a 10 mg y luego a 30 mg como se tolera [ver Dosis y administración ] |
Preparación y administración
Los productos farmacéuticos parenterales deben inspeccionarse visualmente para partículas y decoloración antes de la administración. Si hay partículas presentes o la solución se decolora, descarte el vial. No agite el vial.
Use la técnica aséptica durante la preparación y administración de Campath. Retire la cantidad necesaria de campatinas del vial en una jeringa.
- Para preparar la dosis de 3 mg, retirar 0.1 ml en una jeringa de 1 ml calibrada en incrementos de 0.01 ml.
- Para preparar la dosis de 10 mg, retirar 0.33 ml en una jeringa de 1 ml calibrada en incrementos de 0.01 ml.
- Para preparar la dosis de 30 mg, retira 1 ml en una jeringa de 1 ml o 3 ml calibrada en incrementos de 0.1 ml.
Inyectar contenido de la jeringa en 100 ml de cloruro de sodio al 0,9% usp o dextrosa al 5% en el agua USP. Invierta suavemente la bolsa para mezclar la solución. Deseche la jeringa.
El vial no contiene conservantes y está destinado a un solo uso único. Deseche el vial, incluida cualquier porción no utilizada después de la retirada de la dosis.
Use dentro de las 8 horas posteriores a la dilución. Almacene el campamento diluido a temperatura ambiente entre 15 ° C y 30 ° C (59 ° F a 86 ° F) o se refrigere a 2 ° C a 8 ° C (36 ° F a 46 ° F). Proteger de la luz.
Incompatibilidades
Campath es compatible con bolsas de polivinilcloruro (PVC) y conjuntos de administración de PVC forrados con PVC o polietileno. No agregue ni infunda simultáneamente otras sustancias farmacológicas a través de la misma línea intravenosa.
Que suministrado
Formas de dosificación y fortalezas
Inyección : 30 mg/1 ml como una solución incolora clara en un vial de dosis única
Almacenamiento y manejo
Campata (Alemtuzumab) se suministra en un vial de dosis simple de vidrio transparente que contiene 30 mg de alemtuzumab en 1 ml de solución. Cada cartón contiene tres viales de campamento ( NDC 58468â0357-3) o un vial de Campath ( NDC 58468-0357-1).
Almacene Campath a 2 ° C a 8 ° C (36 ° F a 46 ° F). No se congele. Si accidentalmente se descongela a 2 ° C a 8 ° C antes de la administración. Proteja de la luz solar directa.
¿Es Zoloft un medicamento contra la ansiedad?
Fabricado y distribuido por: Genzyme Corporation Cambridge MA 02142 Número de licencia de los EE. UU.: 1596. Revisado: Abr 2023
Efectos secundarios para el campamento
Las siguientes reacciones adversas clínicamente significativas se discuten con mayor detalle en otras secciones de la etiqueta:
- Citopenias [see ADVERTENCIAS AND PRECAUCIONES ]
- Reacciones relacionadas con la infusión [ver ADVERTENCIAS AND PRECAUCIONES ]
- Inmunosupresión/infecciones [ver ADVERTENCIAS AND PRECAUCIONES ]
Experiencia de ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones ampliamente variables, las tasas de reacción adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
Los datos a continuación reflejan la exposición a Campath en 296 pacientes con CLL de los cuales 147 no fueron tratados previamente y 149 recibieron al menos 2 regímenes de quimioterapia anteriores. La mediana de la duración de la exposición fue de 11.7 semanas para pacientes no tratados previamente y 8 semanas para pacientes tratados previamente.
Las reacciones adversas más comunes con Campath son: reacciones relacionadas con la infusión (pyrexia escalofríos hipotensiones urticaria náuseas tacicardia disnea) citopenias (neutropenia linfopenia trombocitopenia anemia) infecciones por infecciones por cmv viremia cmv infectadas) gastresis (naises de naises (naises de naises (naises (naises (naises (naises (naises (náises de la napa) (naises (naguementos) (naises de naises (naguementos) (naises de naises (naguementos) (naguementos) (naises de naises (naguementos) (naguementos) (naguementos). y síntomas neurológicos (ansiedad por insomnio). Las reacciones adversas graves más comunes son las reacciones relacionadas con la infusión de las citopenias y la inmunosupresión/infecciones.
Linfopenia
La linfopenia severa y una disminución rápida y sostenida de los subconjuntos de linfocitos se produjeron en pacientes previamente no tratados y tratados previamente después de la administración de Campath. En pacientes no tratados previamente, la mediana CD4 fue 0 células/μl al mes después del tratamiento y 238 células/μl [25% -75% de rango intercuartil 115 a 418 células/μl a los 6 meses después del tratamiento [ver el tratamiento [ver el tratamiento [ver el tratamiento [ver ADVERTENCIAS AND PRECAUCIONES ]
Neutropenia
En pacientes no tratados previamente, la incidencia de neutropenia de grado 3 o 4 fue del 42% con un tiempo medio de inicio de 31 días y una duración media de 37 días. En pacientes tratados previamente, la incidencia de neutropenia de grado 3 o 4 fue del 64% con una duración media de 28 días. El diez por ciento de los pacientes no tratados previamente y el 17% de los pacientes tratados previamente recibieron factores estimulantes de colonias de granulocitos.
Anemia
En pacientes previamente no tratados, la incidencia de anemia de grado 3 o 4 fue del 12% con un tiempo medio de inicio de 31 días y una duración media de 8 días. En pacientes tratados previamente, la incidencia de anemia de grado 3 o 4 fue del 38%. El diecisiete por ciento de los pacientes no tratados previamente y el 66% de los pacientes tratados previamente recibieron transfusiones de agentes estimulantes de eritropoiesis o ambas.
Trombocitopenia
En pacientes no tratados previamente, la incidencia de trombocitopenia de grado 3 o 4 fue del 14% con un tiempo medio de inicio de 9 días y una duración media de 14 días. En pacientes tratados previamente, la incidencia de trombocitopenia de grado 3 o 4 fue del 52% con una duración media de 21 días. La trombocitopenia autoinmune se informó en el 2% de los pacientes tratados previamente con una mortalidad.
Reacciones relacionadas con la infusión
Las reacciones relacionadas con la infusión que incluían la hipotensión de los escalofríos de la pirexia urticaria y la disnea eran comunes. La pirexia y/o los escalofríos de grado 3 y 4 ocurrieron en aproximadamente el 10% de los pacientes no tratados previamente y en aproximadamente el 35% de los pacientes tratados previamente. La aparición de reacciones relacionadas con la infusión fue mayor durante la semana inicial de tratamiento y disminuyó con dosis posteriores de campath. Todos los pacientes fueron pretratados con antipiréticos y antihistamínicos; Además, el 43% de los pacientes no tratados previamente recibieron pretratamiento glucocorticoides.
Infecciones
En el estudio de pacientes no tratados previamente, se analizó semanalmente para CMV utilizando un ensayo de PCR del inicio hasta la finalización de la terapia y cada 2 semanas durante los primeros 2 meses después de la terapia. La infección por CMV ocurrió en el 16% (23/147) de pacientes no tratados previamente; Aproximadamente un tercio de estas infecciones fueron graves o amenazantes de la vida. En estudios de pacientes tratados previamente en los que no se requería la vigilancia de CMV rutinaria se documentó la infección por CMV en el 6% (9/149) de los pacientes; Casi todas estas infecciones fueron graves o amenazantes de la vida.
Se informaron otras infecciones en aproximadamente el 50% de los pacientes en todos los estudios. Grado 3 a 5 sepsis varió del 3% al 10% entre los estudios y fue mayor en pacientes tratados previamente. Grado 3 a 4 neutropenia febril varió de 5% a 10% entre los estudios y fue mayor en pacientes tratados previamente. Las muertes relacionadas con la infección ocurrieron en el 2% de los pacientes no tratados previamente y el 16% de los pacientes tratados previamente. Hubo 198 episodios de otras infecciones en 109 pacientes previamente no tratados; 16% eran bacterianos 7% eran hongos 4% eran otros virales y en el 73% no se identificaba el organismo.
Cardíaco
Cardíaco dysrhythmias occurred in approximately 14% of previously untreated patients. The majority were tachycardias y were temporally associated with infusion; dysrhythmias were Grade 3 or 4 in 1% of patients.
Pacientes no tratados previamente
La Tabla 1 contiene reacciones adversas seleccionadas observadas en 294 pacientes aleatorizados (1: 1) para recibir campath o clorambucil como terapia de primera línea para B-CLL. Campath se administró a una dosis de 30 mg por vía intravenosa tres veces por semana durante hasta 12 semanas. La mediana de duración de la terapia fue de 11,7 semanas con una dosis semanal media de 82 mg (25% -75% de rango intercuartil: 6990 mg).
Tabla 1: por paciente incidencia de reacciones adversas seleccionadas* en pacientes ingenuos B-CLL
| Campata (n = 147) | Clorambucil (n = 147) | ||||
| Todos los grados † % | Grados 3-4 % | Todas las calificaciones % | Grados 3-4 % | ||
| Trastornos de la sangre y el sistema linfático | Linfopenia | 97 | 97 | 9 | 1 |
| Neutropenia | 77 | 42 | 51 | 26 | |
| Anemia | 76 | 13 | 54 | 18 | |
| Trombocitopenia | 71 | 13 | 70 | 14 | |
| Trastornos generales y condiciones del sitio de administración | Pirexia | 69 | 10 | 11 | 1 |
| Escalofríos | 53 | 3 | 1 | 0 | |
| Infecciones y Infestations | Viremia CMV ‡ | 55 | 4 | 8 | 0 |
| Infección por CMV | 16 | 5 | 0 | 0 | |
| Otras infecciones | 74 | 21 | 65 | 10 | |
| Piel y trastornos del tejido subcutáneo | Urticaria | 16 | 2 | 1 | 0 |
| Erupción | 13 | 1 | 4 | 0 | |
| Eritema | 4 | 0 | 1 | 0 | |
| Trastornos vasculares | Hipotensión | 16 | 1 | 0 | 0 |
| Hipertensión | 14 | 5 | 2 | 1 | |
| Trastornos del sistema nervioso | Dolor de cabeza | 14 | 1 | 8 | 0 |
| Temblor | 3 | 0 | 1 | 0 | |
| Trastornos torácicos y mediastínicos respiratorios | Dyspnea | 14 | 4 | 7 | 3 |
| Trastornos gastrointestinales | Diarrea | 10 | 1 | 4 | 0 |
| Trastornos psiquiátricos | Insomnio | 10 | 0 | 3 | 0 |
| Ansiedad | 8 | 0 | 1 | 0 | |
| Cardíaco Disorders | Taquicardia | 10 | 0 | 1 | 0 |
| * Reacciones adversas que ocurren a una frecuencia relativa más alta en el brazo de la campura † NCI CTC versión 2.0 para reacciones adversas; NCI CTCAE versión 3.0 para valores de laboratorio ‡ La viremia del CMV (sin evidencia de síntomas) incluye ambos casos de resultados de pruebas positivas para PCR individuales y de viremia CMV confirmada (≥2 ocasiones en muestras consecutivas de 1 semana de diferencia). Para este último ganciclovir (o equivalente) se inició por protocolo. |
Pacientes tratados previamente
Se obtuvo información de seguridad adicional de 3 estudios de un solo brazo de 149 pacientes tratados previamente con CLL administrado 30 mg Campath por vía intravenosa tres veces por semana durante 4 a 12 semanas (dosis acumulativa media 673 mg [rango 2-1106 mg]; duración mediana de la terapia de 8.0 semanas). Las reacciones adversas en estos estudios no figuran en la Tabla 1 que ocurrieron a una tasa de incidencia de> 5% fueron fatiga náusea emesis dolor musculoesquelético mucositis anorexia disestesia y broncoespasmo.
Inmunogenicidad
Al igual que con todas las proteínas terapéuticas, existe potencial de inmunogenicidad. La incidencia de la formación de anticuerpos depende en gran medida de la sensibilidad y especificidad del ensayo. Además, la incidencia observada de la positividad de anticuerpos (incluido el anticuerpo neutralizante) en un ensayo puede estar influenciada por varios factores, incluida la metodología de ensayo, el tiempo de manejo de la muestra de los medicamentos concomitantes de la recolección de muestras y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos con la incidencia de anticuerpos con otros productos de alemtuzumab puede ser engañosa.
El uso de un ensayo ELISA se detectó anticuerpos antihumanos (jaja) en 11 de 133 (8.3%) pacientes no tratados previamente. Además, dos pacientes fueron débilmente positivos para la actividad neutralizante. Los datos limitados sugieren que los anticuerpos anti-campath no afectaron negativamente la respuesta tumoral. Se encontró que cuatro de 211 (1.9%) pacientes previamente tratados tenían anticuerpos contra el campamento después del tratamiento.
Experiencia de postalketing
Campata
Las siguientes reacciones adversas se han identificado durante el uso posterior a la apropiación de Campath. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a los medicamentos.
Trastornos generales y condiciones del sitio de administración: Reacciones fatales relacionadas con la infusión.
Trastornos cardiovasculares: La cardiomiopatía de insuficiencia cardíaca congestiva disminuyó la fracción de eyección (algunos pacientes habían sido tratados previamente con agentes cardiotóxicos).
Trastornos cerebrovasculares: Capacio de disección arterial cervicocefálica que incluye un accidente cerebrovascular hemorrágico e isquémico.
Trastornos gastrointestinales: Colecistitis acalcula aguda.
Trastornos del sistema inmune: Síndrome de Goodpasture La enfermedad de las tumbas de la anemia aplásica del síndrome de guillain-barra-Barré, la polirradiculoneuropatía desmieloneuropatía crónica del injerto fatal del injerto asociado versus enfermedad hemofagocítica de la enfermedad hemofagocítica (HLH).
Infecciones: Infección Epstein-Barr (EBV) Infección Progresiva de leucoencefalopatía multifocal (PML) Reactivación de virus latentes.
Metabolismo y trastornos nutricionales: Síndrome de lisis tumoral.
Neoplasias: Trastorno linfoproliferativo asociado a EBV.
Trastornos del sistema nervioso: Neuropatía óptica.
Trastornos renales y urinarios: Nefropatías glomerulares.
Otros productos de alemtuzumab
Las siguientes reacciones adversas se han identificado durante el uso posterior a la apropiación de otro producto de alemtuzumab. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a los medicamentos.
Trastornos endocrinos: Hipotiroidismo hipertiroidismo y tiroiditis.
Trastornos del sistema nervioso: Encefalitis autoinmune.
Interacciones de drogas para el campamento
No se han realizado estudios formales de interacción de drogas con Campath.
Advertencias para el campamento
Incluido como parte del PRECAUCIONES sección.
Precauciones para el campamento
Citopenias
Severa, incluida la anemia autoinmune fatal y la trombocitopenia y la mielosupresión prolongada en pacientes que reciben campath.
Además, la anemia hemolítica aplasia pura aplasia ósea aplasia e hipoplasia se ha informado después del tratamiento con campatía en la dosis recomendada. Las dosis individuales de campatinas superiores a 30 mg o dosis acumulativas superiores a 90 mg por semana aumentan la incidencia de pancitopenia.
Retener el campatino para citopenias severas (excepto linfopenia). Descontinúo de citopenias autoinmunes o citopenias severas recurrentes/persistentes (excepto linfopenia) [ver Dosis y administración ] No data exist on the safety of Campata resumption in patients with autoimmune cytopenias or marrow aplasia [see Reacciones adversas ]
Obtenga recuentos sanguíneos completos (CBC) a intervalos semanales durante la terapia Campath y con más frecuencia si se produce una anemia por nutropenia o trombocitopenia. Evaluar los recuentos de CD4 después del tratamiento hasta la recuperación a ≥200 células/μl [ver Dosis y administración y Reacciones adversas ]
¿Amox clav es un antibiótico fuerte?
Reacciones relacionadas con la infusión
Las reacciones adversas que ocurren durante o poco después de la infusión de Campath incluyen escalofríos de pyrexia/rigores de náuseas Hipotensión urticaria emesis de erupción disnea y broncoespasmo [ver Reacciones adversas ] In clinical trials the frequency of infusion-related reactions was highest in the first week of treatment. Monitor for the signs y symptoms listed above y withhold infusion for Grade 3 or 4 infusion-related reactions.
Se han identificado las siguientes reacciones relacionadas con la infusión fatales en informes de postmarketing: infiltrados pulmonares de síncope Síndrome de dificultad respiratoria aguda (ARDS) parto respiratorio arritmias infartos miocárdicos Insuficiencia cardíaca de paro cardíaco Angioedema y choque anafilactoideo.
Iniciar Campath de acuerdo con el esquema recomendado de escala de dosis [ver Dosis y administración ] Premedicate patients with an antihistamine y acetaminophen prior to each dose. Institute appropriate medical management (e.g. glucocorticoids epinephrine meperidine) for infusion-related reactions as needed [see Dosis y administración ] If therapy is interrupted for 7 or more days reinstitute Campata with gradual dose escalation [see Dosis y administración ]
Inmunosupresión/infecciones
Campata treatment results in severe y prolonged lymphopenia with a concomitant increased incidence of opportunistic infections [see Reacciones adversas ] Administer PCP y herpes viral prophylaxis during treatment with Campata y for a minimum of 2 months after completion of Campata or until the CD4+ count is ≥200 cells/μL whichever occurs later [see Dosis y administración ] Prophylaxis does not eliminate these infections.
Controle rutinariamente a los pacientes para la infección por CMV durante el tratamiento con Campath y durante al menos 2 meses después de completar el campatino. Retener el campatino para infecciones graves y durante el tratamiento antiviral para la infección por CMV o la viremia CMV confirmada (definida como reacción en cadena de polimerasa [PCR] CMV positiva en ≥2 muestras consecutivas obtenidas 1 semana de diferencia). Iniciar ganciclovir terapéutico (o equivalente) para la infección por CMV o la viremia CMV confirmada.
La infección por el virus Epstein-Barr (EBV), incluida la hepatitis severa y fatal asociada a EBV, se ha informado en pacientes que recibieron campath.
Monitorear el signo y los síntomas de las infecciones por EBV. Retener el campatino para la reactivación de EBV o la infección severa.
Administrar solo productos sanguíneos irradiados para evitar la enfermedad del injerto versus el huésped (TAGVHD) asociado a la transfusión (TAGVHD) a menos que las circunstancias emergentes dicten la transfusión inmediata.
En pacientes que recibieron campath como la recuperación de la terapia inicial de los recuentos de CD4 a ≥200 células/μl ocurrieron en 6 meses después de completar el campath; Sin embargo, a los 2 meses después del tratamiento, la mediana fue de 183 células/μl. En pacientes tratados previamente que recibieron Campath, el tiempo medio de recuperación de los recuentos de CD4 a ≥200 células/μl fue de 2 meses; Sin embargo, la recuperación completa (hasta la línea de base) de los recuentos de CD4 y CD8 puede llevar más de 12 meses [ver Reacciones adversas ]
Inmunización
No se ha estudiado la seguridad de la inmunización con las vacunas virales vivas después de la terapia de campath. No administre vacunas virales vivas a pacientes o bebés nacidos de pacientes que reciben campath. No se ha estudiado la capacidad de generar una respuesta inmune a cualquier vacuna después de la terapia de campath.
Toxicología no clínica
Carcinogénesis Mutagénesis Deterioro de la fertilidad
No se han realizado estudios para evaluar el potencial cancerígeno o genotóxico de Campath.
En estudios de fertilidad, se administró alemtuzumab (3 o 10 mg/kg por vía intravenosa) a ratones machos transgénicos HUCD52 en 5 días consecutivos antes de la cohabitación con mujeres de tipo salvaje no tratadas. No se observó ningún efecto sobre la fertilidad o el rendimiento reproductivo. Sin embargo, se observaron efectos adversos sobre los parámetros de los espermatozoides (incluida la morfología anormal [separado/no cabeza] y el recuento total reducido y la motilidad) en ambas dosis probadas.
Cuando el alemtuzumab (3 o 10 mg/kg por vía intravenosa) se administró a ratones hembra transgénica HUCD52 durante 5 días consecutivos antes de la convivencia con la convivencia con hombres salvajes no tratados, hubo una disminución en el número promedio de sitios corporativos de Lutea y los sitios de implantación y un aumento en la pérdida de posimantación que resultó en pocas verduras viables en el surgimiento viable en el embryos más alto.
Uso en poblaciones específicas
Embarazo
Resumen de riesgos
Basado en los hallazgos de los estudios de animales, el campath puede causar daño fetal cuando se administra a una mujer embarazada. Los datos disponibles de los estudios de cohortes publicados en mujeres embarazadas son insuficientes para establecer un riesgo asociado al campatino de defectos de nacimiento importantes aborto espontáneo o resultados adversos maternos o fetales. Alemtuzumab era embriooletal en ratones transgénicos hucd52 embarazadas cuando se administró durante la organogénesis (ver Datos ). Se sabe que los anticuerpos IgG humanos cruzan la barrera placentaria; Por lo tanto, el campath puede transmitirse de la madre al feto en desarrollo. Asesorar a las mujeres sobre el riesgo potencial para el feto. Los bebés nacidos de mujeres embarazadas tratadas con el campamento pueden tener un mayor riesgo de infección (ver Consideraciones clínicas ).
Se desconoce el riesgo de fondo de los principales defectos de nacimiento y el aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo antecedente de pérdida de defectos de nacimiento u otros resultados adversos. En la población general de los EE. UU., El riesgo de antecedentes estimado de los principales defectos de nacimiento y el aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20% respectivamente.
Consideraciones clínicas
Reacciones adversas fetales/neonatales
Los anticuerpos monoclonales se transportan a través de la placenta a medida que el embarazo progresa con la mayor cantidad transferida durante el tercer trimestre. Considere los riesgos y beneficios de administrar vacunas en vivo o atenuadas en vivo a los bebés expuestos a Campath In Utero [ver ADVERTENCIAS AND PRECAUCIONES ]
Datos
Datos animales
Cuando se administró alemtuzumab a ratones transgénicos Hucd52 embarazadas durante la organogénesis (días de gestación [GD] 6-10 o GD 11-15) a dosis intravenosas de 3 o 10 mg/kg no se observaron efectos teratogénicos. Sin embargo, hubo un aumento en la embriooletalidad (una mayor pérdida de postimplantación y el número de presas con todos los fetos muertos o reabsorbidos) en animales embarazados dosados durante GD 11-15. En un estudio separado en la administración de ratones transgénicos embarazados de alemtuzumab durante la organogénesis (GD 6-10 o GD 11-15) a dosis intravenosas de 3 o 10 mg/kg disminuyendo en las poblaciones de linfocitos B y lymfocitos T se observaron en la desplazamiento en ambas dosis probadas.
En ratones transgénicos embarazados administrados alemtuzumab a dosis intravenosas de 3 o 10 mg/kg/día durante la gestación y la lactancia, hubo un aumento en las muertes de cachorros durante el período de lactancia a 10 mg/kg. Se observaron disminuciones en las poblaciones de linfocitos T y linfocitos B y en la respuesta de anticuerpos en la descendencia a ambas dosis probadas.
Lactancia
Resumen de riesgos
No hay datos sobre la presencia de alemtuzumab en los efectos de la leche humana en la producción de leche o en el niño amamantado. Se desconocen los efectos de la exposición gastrointestinal local y la exposición sistémica limitada en el bebé amamantado a alemtuzumab. Se detectó alemtuzumab en la leche de ratones transgénicos hucd52 lactantes administrados alemtuzumab (ver Datos ). Maternal IgG is known to be present in human milk y when a drug is present in animal milk it is likely that the drug will be present in human milk.
Debido al potencial de reacciones adversas graves del campatinas en un niño amamantado, incluidos los recuentos reducidos de linfocitos, aconsejan a las mujeres lactantes que no amamanten durante el tratamiento con Campath y durante al menos 3 meses después de la última dosis.
Datos
Se detectó alemtuzumab en la leche de ratones transgénicos hucd52 lactantes después de la administración intravenosa de alemtuzumab a una dosis de 10 mg/kg en los días posparto 8-12. Los niveles séricos de alemtuzumab fueron similares en ratones lactantes y descendientes en el día 13 posparto 13 y se asociaron con evidencia de actividad farmacológica (disminución en los recuentos de linfocitos) en la descendencia.
Hembras y machos de potencial reproductivo
Campata may cause embryo-fetal harm when administered to pregnant women [see Uso en poblaciones específicas ]
Embarazo Testing
Embarazo testing is recommended for females of reproductive potential prior to initiating Campata therapy.
Anticoncepción
Hembras
Aconsejan a las pacientes femeninas sobre el potencial reproductivo para usar una anticoncepción efectiva durante el tratamiento con Campath y durante al menos 3 meses después de la última dosis.
Esterilidad
Basado en hallazgos de estudios en animales, alemtuzumab puede afectar la fertilidad en mujeres y machos de potencial reproductivo [ver Toxicología no clínica ] The reversibility of the effect on fertility is unknown.
¿Cuál es el mg más alto de oxicodona?
Uso pediátrico
La seguridad y la efectividad del campath no se han establecido en pacientes pediátricos.
Uso geriátrico
De 147 pacientes con B-CLL no tratados previamente tratados con campath 35% eran ≥ edad 65 y 4% eran ≥ edad 75. De 149 pacientes tratados previamente con B-CLL 44% eran ≥65 años de edad y el 10% eran ≥75 años de edad. Los estudios clínicos de Campath no incluyeron el número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los pacientes mayores y los más jóvenes.
Información de sobredosis para Campath
En toda la experiencia clínica, la dosis única máxima informada recibida fue de 90 mg. Las infecciones de aplasia de la médula ósea o las reacciones graves relacionadas con la infusión ocurrieron en pacientes que recibieron una dosis más alta de lo recomendado.
Un paciente que recibió una dosis de 80 mg por vía intravenosa experimentó tos de broncoespasmo agudo y disnea seguido de anuria y muerte. Otro paciente recibió dos dosis de 90 mg por vía intravenosa un día de diferencia durante la segunda semana de tratamiento y experimentó una aparición rápida de aplasia de médula ósea.
No hay un antídoto específico conocido para la sobredosis de Campath. Deseche el campamento y proporcione terapia de apoyo.
Contraindicaciones para el campamento
Ninguno.
Farmacología clínica for Campath
Mecanismo de acción
Campata binds to CD52 an antigen present on the surface of B y T lymphocytes a majority of monocytes macrophages NK cells y a subpopulation of granulocytes. A proportion of bone marrow cells including some CD34+ cells express variable levels of CD52. The proposed mechanism of action is antibody-dependent cellular-mediated lysis following cell surface binding of Campata to the leukemic cells.
Farmacodinámica
Cardíaco Electrophysiology
El efecto de múltiples dosis de alemtuzumab (12 mg/día durante 5 días) en el intervalo QTC se evaluó en un estudio de un solo brazo en 53 pacientes sin malignidad. En el estudio no se detectaron grandes cambios en el intervalo QTC medio (es decir,> 20 ms). Se observó un aumento medio de la frecuencia cardíaca de 22 a 26 latidos/min durante al menos 2 horas después de la infusión inicial de alemtuzumab. Este aumento en la frecuencia cardíaca no se observó con dosis posteriores.
¿Se puede usar Seroquel para dormir?
Farmacocinética
Campata pharmacokinetics were characterized in a study of 30 previously treated B-CLL patients in whom Campata was administered at the recommended dose y schedule. After 12 weeks of dosing patients exhibited a 7-fold increase in mean AUC.
Distribución
Después de la última dosis de 30 mg, el volumen medio de distribución en estado estable fue de 0.18 l/kg (rango 0.1 a 0.4 l/kg).
Eliminación
Campata pharmacokinetics displayed nonlinear elimination kinetics. Systemic clearance decreased with repeated administration due to decreased receptor-mediated clearance (i.e. loss of CD52 receptors in the periphery). Mean half-life was 11 hours (range 2 to 32 hours) after the first 30 mg dose y was 6 days (range 1 to 14 days) after the last 30 mg dose.
Poblaciones específicas
No se han estudiado los efectos del deterioro renal o hepático en la farmacocinética de Campath.
Estudios clínicos
Pacientes con B-CLL no tratados previamente
Campata was evaluated in an open-label ryomized (1:1) active-controlled study in previously untreated patients with B-CLL Rai Stage I-IV with evidence of progressive disease requiring therapy. Patients received either Campata 30 mg intravenously 3 times per week for a maximum of 12 weeks or chlorambucil 40 mg/m² orally once every 28 days for a maximum of 12 cycles.
De los 297 pacientes al azar, la mediana de edad fue de 60 años 72% eran hombres 99% eran caucásicos, 96% tenían un estado de rendimiento de la OMS 0-1 23% tenía un diámetro máximo de ganglios linfáticos ≥5 cm 34% eran RAI en etapa III/IV fueron tratados en los EE. UU. En los EE. UU.
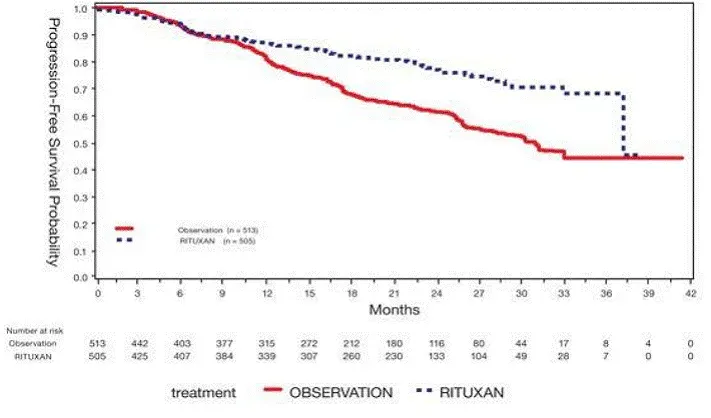
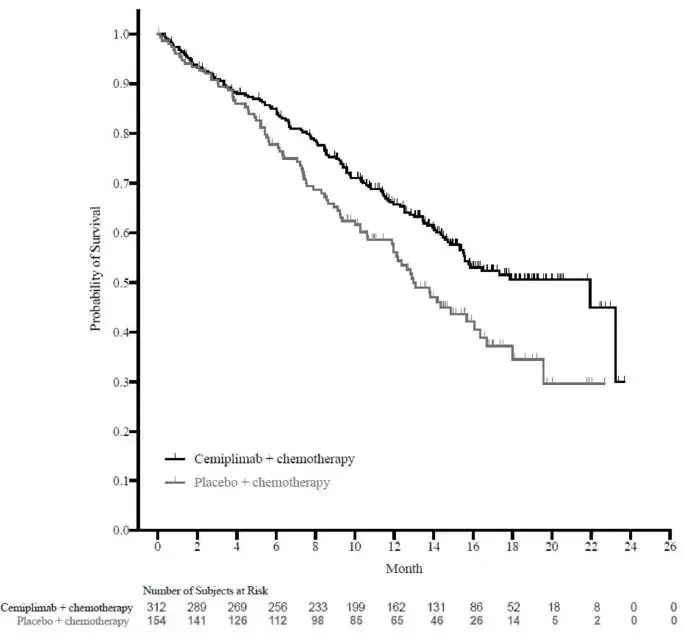
Los pacientes aleatorizados para recibir Campath experimentaron una supervivencia libre de progresión más larga (SLP) en comparación con aquellos aleatorizados para recibir clorambucil (mediana de SLP 14.6 meses frente a 11.7 meses respectivamente). Las tasas de respuesta generales fueron del 83% y 55% (P <0.0001) y the complete response rates were 24% y 2% (p <0.0001) for Campata y chlorambucil arms respectively. The Kaplan-Meier curve for PFS is shown in Figure 1.
Figura 1: Supervivencia libre de progresión en pacientes con B-CLL no tratados previamente*
 |
* Prueba de log-rank ajustada para la etapa RAI (I-II vs. III-IV).
Pacientes con B-CLL tratados previamente
Campata was evaluated in three multicenter open-label single-arm studies of 149 patients with B-CLL previously treated with alkylating agents fludarabine or other chemotherapies. Patients were treated with the recommended dose of Campata 30 mg intravenously 3 times per week for up to 12 weeks. Partial response rates of 21% to 31% y complete response rates of 0% to 2% were observed.
Información del paciente para el campamento
Citopenias
Aconseje a los pacientes que denuncien cualquier signo o síntoma, como hemorragia, hematoma de hematoma, debilidad o fatiga palidez ADVERTENCIAS AND PRECAUCIONES y Reacciones adversas ]
Reacciones relacionadas con la infusión
Asesorar a los pacientes de los signos y síntomas de las reacciones relacionadas con la infusión y de la necesidad de tomar premedaciones según lo prescrito [ver ADVERTENCIAS AND PRECAUCIONES y Reacciones adversas ]
Inmunosupresión/infecciones
Asesorar a los pacientes que informen inmediatamente síntomas de infección (por ejemplo, pirexia) y que tomen antiinfectivos profilácticos para PCP (trimetoprima/sulfametoxazol DS o equivalente) y para el virus del herpes (famciclovir o equivalente) según lo prescrito [ver [ver [ver) ADVERTENCIAS AND PRECAUCIONES y Reacciones adversas ]
Aconsejar a los pacientes que se requiere irradiación de productos sanguíneos [ver ADVERTENCIAS AND PRECAUCIONES ]
Inmunización
Aconseje a los pacientes que no deben ser inmunizados con vacunas virales vivas si se han tratado recientemente con Campath. Asesorar a las mujeres con bebés expuestos a Campath in útero para informar al pediatra de la exposición [ver ADVERTENCIAS AND PRECAUCIONES ]
Toxicidad embrionaria
Asesorar a las mujeres y mujeres embarazadas del potencial reproductivo del riesgo potencial para un feto. Aconsejar a las mujeres que informen a su proveedor de atención médica de un embarazo conocido o sospechoso [ver Uso en poblaciones específicas ]
Asesorar a las pacientes con potencial reproductivo para usar una anticoncepción efectiva durante el tratamiento con Campath y durante 3 meses después de la dosis final [ver Uso en poblaciones específicas ]
Lactancia
Aconsejar a las mujeres que no amamanten durante el tratamiento con Campath y durante 3 meses después de la dosis final [ver Uso en poblaciones específicas ]
Esterilidad
Asesorar a las mujeres y machos del potencial reproductivo que el campath puede afectar la fertilidad [ver Uso en poblaciones específicas y Toxicología no clínica ]
Nefropatías glomerulares
Asesorar a los pacientes sobre signos y síntomas de las nefropatías glomerulares que pueden ocurrir de meses o años después de recibir el campamento [ver Reacciones adversas ]