Libuta
La Información De Este Sitio No Constituye Asesoramiento Médico. No Vendemos Nada. No Se Garantiza La Precisión De La Traducción. Descargo De Responsabilidad
Resumen de drogas
¿Qué es Libtayo?
Libtayo (Cemiplimab-RWLC) es un anticuerpo de bloqueo del receptor de muerte programado (PD-1) indicado para el tratamiento de pacientes con células escamosas cutáneas metastásicas carcinoma (CSCC) o CSCC localmente avanzado que no son candidatos para cirugía curativa o radiación curativa.
¿Qué son los efectos secundarios de Libtayo?
Libuta
- urticaria
- Dificultad para respirar
- hinchazón de tu cara labios lengua o garganta
- fiebre
- dolor de garganta
- ojos ardientes
- dolor de piel
- erupción de piel roja o púrpura con ampollas y peladas
- mareo
- shakakess
- mareal
- escalofríos
- picor
- estremecimiento
- erupción
- cuello o dolor de espalda
- tos nueva o empeoramiento
- dificultad para respirar
- dolor en el pecho
- latidos rápidos o irregulares
- glándulas hinchadas
- convulsión
- dolor de cabeza severo
- confusión
- alucinaciones
- dolor o ojo o enrojecimiento
- problemas de visión
- Mayor sensibilidad a la luz
- Dolor o debilidad muscular severo
- rigidez del cuello
- dolor de estómago severo
- náuseas
- vómitos
- diarrea
- Heces sangrientas o alquitranadas
- hematomas inusuales
- llagas en la boca
- dolor de estómago
- sentirse enfermo o inquieto
- erupción
- dolor o hinchazón cerca de su órgano trasplantado
- hinchazón en tus tobillos
- sangre en tu orina
- poca o ninguna micción
- dolor de estómago superior del lado derecho
- pérdida de apetito
- modorra
- Hemorizas fáciles
- sangrado inusual
- orina oscura
- amarillamiento de la piel o los ojos ( ictericia )
- dolores de cabeza frecuentes o inusuales
- mareo
- Sentirse muy cansado
- Cambios de estado de ánimo o comportamiento
- voz ronca o profunda
- aumento del hambre o sed
- Aumento de orina
- constipación
- pérdida de cabello
- transpiración
- sintiéndose frío
- aumento de peso y
- pérdida de peso
Obtenga ayuda médica de inmediato si tiene alguno de los síntomas enumerados anteriormente.
Los efectos secundarios comunes de Libtayo incluyen:
- fatiga
- erupción
- diarrea
- picor
- náuseas
- constipación
- fatiga
- dolor musculoesquelético y
- Disminución del apetito
Libtayo puede causar efectos secundarios graves que incluyen:
Los efectos secundarios más comunes de Libtayo incluyen el músculo de diarrea de la erupción de cansancio de cansancio o dolor de hueso y náuseas.
Estos no son todos los posibles efectos secundarios de Libtayo.
Busque atención médica o llame al 911 a la vez si tiene los siguientes efectos secundarios graves:
- Síntomas oculares graves, como la pérdida de visión repentina, la visión borrosa de la visión del túnel dolor o hinchazón o ver halos alrededor de las luces;
- Síntomas cardíacos graves como latidos irregulares rápidos o laterales; revoloteando en tu pecho; dificultad para respirar; y mareos repentinos alegre o desmayado;
- La confusión severa de dolor de cabeza arrastró el brazo del habla o la debilidad de la pierna, problemas para caminar la pérdida de la coordinación que se siente inestable músculos muy rígidos, fiebre alta sudoración o temblores.
Este documento no contiene todos los efectos secundarios posibles y otros pueden ocurrir. Consulte con su médico para obtener información adicional sobre los efectos secundarios.
Dosis para libtayo
La dosis recomendada de Libtayo es de 350 mg como una infusión intravenosa durante 30 minutos cada 3 semanas. Libtayo puede interactuar con otras drogas. Dígale a su médico todos los medicamentos y suplementos que usa.
¿Qué sustancias o suplementos de medicamentos interactúan con Libtayo?
Dígale a su médico si está embarazada o planea quedar embarazada antes de usar Libtayo; Puede dañar un feto. Se recomienda a las mujeres del potencial reproductivo que usen una anticoncepción efectiva durante el tratamiento con Libtayo y durante al menos 4 meses después de la última dosis.
Libtayo durante el embarazo y la lactancia materna
Se desconoce si Libtayo pasa a la leche materna. Debido al potencial de reacciones adversas graves en los niños amamantados, la lactancia materna no se recomienda durante el tratamiento con Libtayo y durante al menos 4 meses después de la última dosis.
información adicional
Nuestra inyección de Libtayo (Cemiplimab-RWLC) para el Centro de medicamentos de efectos secundarios de uso intravenoso proporciona una visión integral de la información de drogas disponible sobre los posibles efectos secundarios al tomar este medicamento.
Información de drogas de la FDA
- Descripción de drogas
- Indicación
- Dosificación
- Efectos secundarios
- Advertencias
- Sobredosis
- Farmacología clínica
- Guía de medicación
Descripción de Libtayo
Cemiplimab-RWLC es un anticuerpo de bloqueo del receptor de muerte programado humano (PD-1). Cemiplimab-RWLC es un anticuerpo monoclonal IgG4 humano recombinante que se une a PD-1 y bloquea su interacción con PD-L1 y PD-L2. Cemiplimab-RWLC es producido por la tecnología de ADN recombinante en el cultivo de suspensión celular del ovario de hámster chino (CHO). Cemiplimab-RWLC tiene un peso molecular aproximado de 146 kDa.
La inyección de libtayo (cemiplimab-rwlc) para uso intravenoso es una solución estéril libre de conservante a ligeramente opalescente a amarillo pálido con un pH de 6. La solución puede contener pequeñas cantidades de partículas translúcidas a blancas.
Cada vial contiene 350 mg de cemiplimab-rwlc. Cada ML contiene cemiplimab-RWLC 50 mg de L-histidina (0.74 mg) l-histidina monohidrocloruro monohidrato (1.1 mg) sacarosa (50 mg) L-prolina (15 mg) polisorbato 80 (2 mg) y agua para inyección USP.
Usos para Libtayo
Carcinoma de células escamosas cutáneas
Libtayo está indicado para el tratamiento de pacientes con carcinoma de células escamosas cutáneas metastásicas (MCSCC) o CSCC localmente avanzado (LACSCC) que no son candidatos para cirugía curativa o radiación curativa.
Carcinoma de células basales
Libtayo está indicado para el tratamiento de pacientes con carcinoma de células basal localmente avanzado o metastásico (LABCC o MBCC) que han sido tratados previamente con un inhibidor de la vía de Hedgehog o para el cual un inhibidor de la vía Hedgehog no es apropiado.
Cáncer de pulmón de células no pequeñas
Libtayo en combinación con platino quimioterapia está indicado para el tratamiento de primera línea de pacientes adultos con cáncer de pulmón de células no pequeñas (NSCLC) sin NO EGFR ALK o aberraciones ROS1 y es:
- localmente avanzado donde los pacientes no son candidatos para la resección quirúrgica o quimiorradiación definitiva o
- metastásico.
Libtayo como un solo agente está indicado para el tratamiento de primera línea de pacientes adultos con NSCLC cuyos tumores tienen una alta expresión de PD-L1 [puntuación de proporción tumoral (TPS) ≥ 50%] según lo determinado por una prueba aprobada por la FDA [ver Dosis y administración ] sin aberraciones EGFR ALK o ROS1 y es:
- localmente avanzado donde los pacientes no son candidatos para la resección quirúrgica o quimiorradiación definitiva o
- metastásico.
Dosis para libtayo
Selección de pacientes para NSCLC
Seleccione pacientes con NSCLC localmente avanzado o metastásico para el tratamiento con Libtayo como un solo agente basado en la expresión de PD-L1 en las células tumorales [ver Estudios clínicos ]
La información sobre las pruebas aprobadas por la FDA para la detección de la expresión de PD-L1 está disponible en: https://www.fda.gov/CompanionDiaGnitalics.
Dosis recomendada
Carcinoma de células basales avanzadas o metastásicas y carcinoma de células escamosas cutáneas localmente avanzadas o metastásicas
La dosis recomendada de Libtayo es 350 mg administrada como una infusión intravenosa cada 3 semanas hasta la progresión de la enfermedad toxicidad inaceptable o hasta 24 meses.
Cáncer de pulmón de células no pequeñas
La dosis recomendada de Libtayo es 350 mg administrada como una infusión intravenosa cada 3 semanas hasta la progresión de la enfermedad o una toxicidad inaceptable.
Consulte la información de prescripción para los agentes administrados en combinación con Libtayo para obtener información de dosificación recomendada, según corresponda.
Dosificación Modifications Fo Reacción adversas
No se recomienda reducción de la dosis para Libtayo. En general, retenga Libtayo para reacciones adversas severas (grado 3) mediadas por inmunomediadas. Descontinúe permanentemente Libtayo para reacciones adversas inmunomediadas potenciadas (grado 4) que amenazan (grado 4) con reacciones inmunomediadas recurrentes (grado 3) que requieren un tratamiento inmunosupresor sistémico o una incapacidad para reducir la dosis de corticosteroides a 10 mg o menos de la equivalent de prednisona peran dentro de las 12 semanas de inicio de las esteroides.
Dosificación modifications fo Libuta fo adverse reactions that require management different from these general guidelines are summarized in Table 1.
Tabla 1: Modificaciones de dosificación recomendadas para reacciones adversas
| Reacción adversa | Gravedada | Dosificación Modifications |
| Reacciones adversas mediadas por inmunir [ver Advertencias y precauciones ] | ||
| Neumonitis | Grado 2 | Retenerb |
| Grado 3 o 4 | Suspender permanentemente | |
| Colitis | Grado 2 o 3 | Retenerb |
| Grado 4 | Suspender permanentemente | |
| Hepatitis sin afectación tumoral del hígado | AST o ALT aumenta a más de 3 y hasta 8 veces Uln o La bilirrubina total aumenta a más de 1.5 y hasta 3 veces el Uln | Retenerb |
| AST o ALT aumenta a más de 8 veces el Uln o La bilirrubina total aumenta a más de 3 veces el Uln | Suspender permanentemente | |
| Hepatitis con afectación tumoral del hígadoc | La línea de base AST o ALT es más de 1 y hasta 3 veces Uln y aumenta a más de 5 y hasta 10 veces Uln o La línea de base AST o ALT es más de 3 y hasta 5 veces Uln y aumenta a más de 8 y hasta 10 veces Uln | Retenerb |
| AST o ALT aumenta a más de 10 veces Uln o La bilirrubina total aumenta a más de 3 veces Uln | Suspender permanentemente | |
| Endocrinopatías | Grado 3 o 4 | Retener until clinically stable o permanently discontinue depending on severity |
| Nefritis con disfunción renal | Grado 2 o 3 increased blood creatinine | Retenerb |
| Grado 4 increased blood creatinine | Suspender permanentemente | |
| Condiciones dermatológicas exfoliativas | Sospecha de sjs diez o vestirse | Retenerb |
| SJS Confirmado diez o vestirse | Suspender permanentemente | |
| Miocarditis | Grado 2 3 o 4 | Suspender permanentemente |
| Toxicidad neurológica | Grado 2 | Retenerb |
| Grado 3 o 4 | Suspender permanentemente | |
| Otras reacciones adversas | ||
| Reacciones relacionadas con la infusión [ver Advertencias y precauciones ] | Grado 1 o 2 | Interrumpir o ralentizar la tasa de infusión |
| Grado 3 o 4 | Suspender permanentemente | |
| Alt = alanina aminotransferasa AST = aspartato aminotransferasa Uln = Límite superior de SJS normal = Síndrome de Stevens-Johnson diez = Vestido de necrólisis epidérmica tóxica = erupción de fármacos con eosinofilia y síntomas sistémicos a. Basado en los criterios de terminología común del Instituto Nacional del Cáncer para eventos adversos versión 4.0 b. Reanude en pacientes con resolución completa o parcial (grado 0 a 1) después del cono de corticosteroides. Descontinúe permanentemente si no hay una resolución completa o parcial dentro de las 12 semanas posteriores a la iniciación de esteroides o la incapacidad para reducir la prednisona a menos de 10 mg por día (o equivalente) dentro de las 12 semanas posteriores a la iniciación de los esteroides. do. Si AST y ALT son menores o iguales a Uln en la retención de base o suspenden permanentemente Libtayo en función de las recomendaciones de hepatitis sin afectación del hígado |
Preparación y administración
- Inspeccionar visualmente por partículas y decoloración antes de la administración. Libtayo es una solución clara de color amarillo a amarillo pálido claro a ligeramente opalescente que puede contener pequeñas cantidades de partículas translúcidas a blancas. Deseche el vial si la solución está descolorida o contiene partículas extrañas que no sean pequeñas cantidades de partículas translúcidas a blancas.
Preparación
- No te temble.
- Retire 7 ml de un vial y diluido con inyección de cloruro de sodio al 0,9% USP o inyección de dextrosa al 5% USP a una concentración final entre 1 mg/ml a 20 mg/ml.
- Mezcle la solución diluida por inversión suave. No te temble.
- Deseche cualquier medicamento no utilizado o material de desecho.
Almacenamiento de solución de infusión
- Almacene a temperatura ambiente de hasta 25 ° C (77 ° F) durante no más de 8 horas desde el momento de la preparación hasta el final de la infusión o bajo refrigeración a 2 ° C a 8 ° C (36 ° F a 46 ° F) durante no más de 10 días desde el tiempo de preparación hasta el final de la infusión.
- Permita que la solución diluida llegue a la temperatura ambiente antes de la administración.
- No se congele.
Administración
- Administre por infusión intravenosa durante 30 minutos a través de una línea intravenosa que contiene un filtro estéril en línea o adicional de 0.2 micrones a 5 micrones.
Que suministrado
Dosificación Foms And Strengths
Inyección : 350 mg/7 ml (50 mg/ml) Clear a ligeramente opalescente incoloro a amarillo pálido que puede contener pequeñas cantidades de partículas translúcidas a blancas en un vial de dosis única.
Almacenamiento y manejo
Libuta (La inyección de cemiplimab-rwlc) es una solución incolora a amarillo pálida clara a ligeramente opalescente que puede contener pequeñas cantidades de partículas translúcidas a blancas. Se suministra en un cartón que contiene 1 vial de dosis única de:
- 350 mg/7 ml (50 mg/ml) ( NDC 61755-008-01)
Almacene en un refrigerador a 2 ° C a 8 ° C (36 ° F a 46 ° F) en el cartón original. Proteger de la luz. No se congele ni se agite.
Fabricado por: Regeneron Pharmaceuticals Inc. 777 Old Saw Mill River Road Tarrytown NY 10591-6707. Revisado: abril de 2024.
Efectos secundarios para Libtayo
Las siguientes reacciones adversas graves se describen en otra parte del etiquetado.
- Reacciones adversas inmunomediadas graves y fatales [ver Advertencias y precauciones ]
- Reacciones relacionadas con la infusión [ver Advertencias y precauciones ]
- Complicaciones de HSCT alogénico [ver Advertencias y precauciones ]
Experiencia de ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones ampliamente variables, las tasas de reacción adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
Los datos descritos en Advertencias y precauciones Refleja la exposición a Libtayo como un solo agente en 1281 pacientes en tres estudios de mulicohortes de un solo brazo abierto y dos estudios aleatorizados de múltiples centros aleatorios abiertos. Estos estudios incluyeron 384 pacientes con CSCC avanzado (Estudios 1540 y 1423) 138 pacientes con BCC avanzado (Estudio 1620) 355 pacientes con CPNM (estudio 1624) y 404 pacientes con otros tumores sólidos avanzados. Libtayo se administró por vía intravenosa a dosis de 3 mg/kg cada 2 semanas (n = 235) 350 mg cada 3 semanas (n = 1014) u otras dosis (n = 32). Entre los 1281 pacientes 53% estuvieron expuestos durante 6 meses o más y el 26% estuvieron expuestos por un año o más. En esta población de seguridad agrupada, las reacciones adversas más comunes (≥15%) fueron la fatiga del dolor musculoesquelético de la draft draft y anemia. Las anormalidades de laboratorio de grado 3-4 más comunes (≥2%) fueron la hipobercosfatemia de la hiponatremia de la hiponatremia de la linfopenia hiponatremia aumentando la hipercalemia de la aminotransferasa de la aspartato hipercalemia y el aumento de la alanina aminotransferasa.
Además, los siguientes datos reflejan la exposición a Libtayo en combinación con quimioterapia basada en platino en 312 pacientes con CPNME inscrito en un ensayo controlado activo aleatorio (Estudio 16113).
Carcinoma de células escamosas cutáneas (CSCC)
Estudio 1540
La seguridad de Libtayo se evaluó en 358 pacientes con CSCC avanzado (enfermedad metastásica o localmente avanzada) en el estudio 1540 [ver Estudios clínicos ] Of these 358 patients 213 had mCSCC (nodal o distant) y 145 had laCSCC. Patients received Libuta 3 mg/kg every 2 weeks (n=137) o 350 mg every 3 weeks (n=221) as an intravenous infusion until disease progression unacceptable toxicity o completion of planned treatment. The median duration of exposure was 40 weeks (1 week to 109 weeks).
Se produjeron reacciones adversas graves en el 41% de los pacientes. Las reacciones adversas graves que ocurrieron en al menos el 2%de los pacientes fueron la neumonía (3.6%) infección cutánea (3.6%) y neumonitis (2.8%).
Las reacciones adversas fatales ocurrieron en el 5% de los pacientes que recibieron libtayo, incluidas las muertes debido a infecciones (2.2%).
La interrupción permanente debido a una reacción adversa se produjo en el 12% de los pacientes. Las reacciones adversas que dieron como resultado la interrupción permanente en al menos 2 pacientes fueron la erupción de neumonitis Estado confusional Deterioro de salud física general Hemorragia La prueba del hígado de la hepática anormalidades y dolor musculoesquelético.
Dosificación interruptions of Libuta due to an adverse reaction occurred in 36% of patients. Adverse reactions which required dosage interruption in ≥ 2% of patients included diarrea infusion-related reaction upper respiratoy tract infection liver function test abnomalities musculoskeletal pain pneumonitis y erupción.
Las reacciones adversas más comunes (≥ 20%) fueron el dolor musculoesquelético de fatiga diarrea prurito y náuseas. Las reacciones adversas de grado 3 o 4 más comunes (≥ 2%) fueron la hipertensión infección de la piel neumonía anemia fatiga dolor musculoesquelético y neumonitis. Las anomalías de laboratorio más comunes (≥ 4%) de grado 3 o 4 que empeoraron desde el inicio desde la linfopenia hiponatremia y la hipofosfatemia.
La Tabla 2 resume las reacciones adversas que ocurrieron en ≥ 10% de los pacientes y la Tabla 3 resume las anomalías de laboratorio de grado 3 o 4 que empeoran desde el inicio en ≥ 1% de los pacientes que reciben Libtayo.
Tabla 2: Reacciones adversas en ≥ 10% de los pacientes con CSCC avanzado que reciben libtayo en el estudio 1540
| Reacción adversas | Libuta N = 358 | |
| Todos los grados % | Grados 3-4 % | |
| Sitio general y de administración | ||
| a | 38 | 2.2 |
| Piel y tejido subcutáneo | ||
| b | 34 | 1.7 |
| c | 22 | 0.3 |
| 10 | 0 | |
| Tejido musculoesquelético y conectivo | ||
| d | 33 | 2.5 |
| Gastrointestinal | ||
| e | 26 | 1.1 |
| 21 | 0 | |
| 13 | 0.3 | |
| f | 11 | 0.6 |
| Infecciones e infestaciones | ||
| g | 14 | 1.1 |
| h | 11 | 4.5 |
| Respiratorio | ||
| i | 12 | 0 |
| Metabolismo y nutrición | ||
| 11 | 0.6 | |
| Trastornos del sistema nervioso | ||
| j | 10 | 0 |
| k | 10 | 0.3 |
| La toxicidad se calificó por criterio de terminología común del Instituto Nacional del Cáncer para eventos adversos (NCI CTCAE) v.4.03 a. La fatiga es un término compuesto que incluye fatiga y astenia b. La erupción es un término compuesto que incluye erupción cutánea maculo-dermatitis eritema eczema dermatitis dermatitis eritematosa bulosa dermatitis acneiforme dermatitis dermatitis contactos ampollí Eczema reacción de la piel asteatótica Dermatitis psoriasiforme Eczema nummular erupción cutánea y dermatitis inmunomediada do. Prurito es un término compuesto que incluye alérgico prurito y prurito d. Dolor musculoesquelético es un término compuesto que incluye artralgia Dolor de espalda mialgia Poliartritis Dolor en la extremidad Dolor del cuello Dolor táctico no cardíaco Artritis musculoesquelética Dolor en el tóra y. La diarrea es un término compuesto que incluye colitis de diarrea y colitis autoinmune F. El vómitos es un término compuesto que incluye hematemesis y vómitos gramo. La infección del tracto respiratorio superior es un término compuesto que incluye infección del tracto respiratorio superior nasofaringitis sinusitis en enfermedad de influenza rinitis rinitis influenza infección del tracto respiratorio superior infección del tracto respiratorio influenza una prueba de virus un virus h. La infección de la piel es un término compuesto que incluye infección por infección por la piel infección por la piel y infección de la piel estafilocócica i. La tos es un término compuesto que incluye tos productiva para la tos y el síndrome de la tos de la vía aérea superior j. El dolor de cabeza es un término compuesto que incluye dolor de cabeza sinusal y migraña k. Mareos es un término compuesto que incluye mareos vértigo vértigo posicional y mareos posturales |
Tabla 3: Grado 3 o 4 anomalías de laboratorio empeorando desde la línea de base en ≥ 1% de los pacientes con CSCC avanzado que reciben Libtayo en el Estudio 1540
| Anormalidad de laboratorio | Grado 3-4 (%)a |
| Hematología | |
| 7.0 | |
| 4.1 | |
| Electrolitos | |
| 4.9 | |
| 4.1 | |
| 2.0 | |
| 1.5 | |
| Coagulación | |
| 2.9 | |
| Química | |
| 1.5 | |
| 1.2 | |
| Toxicidad calificada por NCI CTCAE v. 4.03 a Los porcentajes se basan en el número de pacientes con al menos 1 valor posterior a la base disponible para ese parámetro |
Estudio 1423
En 26 pacientes con CSCC avanzado tratados con Libtayo en el estudio 1423 [ver Estudios clínicos ] Los datos de seguridad fueron consistentes con los descritos anteriormente del Estudio 1540.
Carcinoma de células basales (BCC)
La seguridad de Libtayo se evaluó en 138 pacientes con BCC avanzado (MBCC n = 54 LABCC n = 84) en un ensayo de un solo brazo abierto (estudio 1620) [ver Estudios clínicos ] Patients received Libuta 350 mg every 3 weeks as an intravenous infusion fo up to 93 weeks o until disease progression o unacceptable toxicity. The median duration of exposure was 45 weeks (range: 2.1 weeks to 98 weeks).
Se produjeron reacciones adversas graves en el 34% de los pacientes. Las reacciones adversas graves que ocurrieron en> 1.5%fueron diarrea (3.6%) infección del tracto urinario (3.6%) neumonía (2.9%) y hemorragia (2.2%). Las reacciones adversas fatales ocurrieron en el 4,3%de los pacientes que recibieron libtayo, incluida la lesión renal aguda (0,7%) y el empeoramiento de la caquexia debido a la colitis (0,7%).
La interrupción permanente de Libtayo debido a una reacción adversa se produjo en el 14% de los pacientes. Las reacciones adversas que resultan en la interrupción permanente de Libtayo en al menos 2 pacientes fueron la diarrea lesión renal aguda deterioro de salud física general y hepatitis.
Las interrupciones de dosis de Libtayo debido a una reacción adversa se produjeron en el 40% de los pacientes. Las reacciones adversas que requirieron interrupciones de dosificación en> 2% de los pacientes incluyeron diarrea dolor musculoesquelética de lesión riñón aguda Fatiga de cabeza de cabeza de reacción relacionada con la infusión de la infección del tracto respiratorio superior e infección del tracto urinario.
Las reacciones adversas más comunes reportadas en al menos el 15% de los pacientes fueron la fatiga, dolor musculoesquelética, damultáneo de diarrea infección del tracto respiratorio superior hemorragia e hipertensión prurito.
Las reacciones adversas de grado 3 o 4 más comunes (> 2%) fueron la fatiga de la diarrea de hipertensión Dolor musculoesquelético Hipocalemia Hiponatremia Neumonía La infección por infección del tracto urinario y el peso disminuyeron. Las anormalidades de laboratorio más comunes (> 2%) que empeoran desde el inicio hasta el grado 3 o 4 fueron la linfopenia e hiponatremia.
La Tabla 4 resume las reacciones adversas que ocurrieron en ≥ 10% de los pacientes y la Tabla 5 resume las anomalías de laboratorio de grado 3 o 4 que empeoran desde el inicio en ≥ 1% de los pacientes que reciben Libtayo.
Tabla 4: Reacciones adversas en ≥ 10% de los pacientes con BCC avanzado que reciben libtayo en el estudio 1620
| Reacción adversas | Libuta N = 138 | |
| Todos los grados % | Grados 3-4 % | |
| Trastornos generales y condiciones del sitio de administración | ||
| a | 50 | 4.3 |
| b | 10 | 0.7 |
| Trastornos musculoesqueléticos y de tejido conectivo | ||
| c | 36 | 2.9 |
| Gastrointestinal disoders | ||
| d | 33 | 4.3 |
| 13 | 0.7 | |
| e | 12 | 1.4 |
| 12 | 0.7 | |
| Piel y trastornos del tejido subcutáneo | ||
| f | 30 | 0.7 |
| 19 | 0 | |
| Infecciones e infestaciones | ||
| g | 22 | 0 |
| h | 13 | 2.2 |
| Trastornos vasculares | ||
| i | 18 | 0.7 |
| j | 17 | 9 |
| Metabolismo y trastornos nutricionales | ||
| 14 | 1.4 | |
| Trastornos de la sangre y el sistema linfático | ||
| 14 | 0.7 | |
| Respiratorio thoacic y mediastinal disoders | ||
| k | 14 | 0 |
| l | 14 | 0 |
| Trastornos del sistema nervioso | ||
| 13 | 1.4 | |
| m | 12 | 0 |
| n | 11 | 0 |
| Trastornos endocrinos | ||
| o | 12 | 0 |
| Investigaciones | ||
| p | 10 | 1.4 |
| La toxicidad se calificó por criterio de terminología común del Instituto Nacional del Cáncer para eventos adversos (NCI CTCAE) v.4.03 a. La fatiga es un término compuesto que incluye astenia por fatiga y malestar b. El edema es un término compuesto que incluye hinchazón periférico e hinchazón de la cara del edema periférico do. El dolor musculoesquelético es un término compuesto que incluye dolor de espalda de artralgia dolor en la extremidad mialgia dolor de cuello dolor pecho no cardíaco artritis musculoesquelética pecho tórax rigidez musculoesquelética incomodidad musculoesquelética y dolor espinal d. La diarrea es un término compuesto que incluye colitis de colitis de diarrea y enterocolitis y. El dolor abdominal es un término compuesto que incluye dolor abdominal dolor abdominal dolor abdominal inferior y dolor gastrointestinal F. La erupción es un término compuesto que incluye erupción cutánea de eccema maculo-papular dermatitis eritema dermatitis acneiforme erupción erupción prurítica dermatitis pustular eccema de eccema dishidrótico alpófiatoides eritematoso urticaria erupción nodular y exoliación de la piel gramo. Infección del tracto respiratorio superior es un término compuesto que incluye infección del tracto respiratorio superior influenza como enfermedad nasofaringitis rinitis sinusitis rinitis viral faringitis laringitis infección del tracto respiratorio influencia del tracto respiratorio vír h. La infección del tracto urinario es un término compuesto que incluye cistitis de infección del tracto urinario y urosepsia i. La hemorragia es un término compuesto que incluye hemorragia tumoral hematuria epistaxis hemorragia ocular hemoptisis hemorragia intracranial hemorrágica diátesis posmenopáusica hemorragia hemorragia hemorragia hemorragia hemorragia hemorragia hemorragio hemorragio hemorragio hemorragio hemorragio hemorragio vagal j. La hipertensión es un término compuesto que incluye la presión arterial de la hipertensión aumentada y la crisis hipertensiva k. La disnea es un término compuesto que incluye disnea y disnea l. La lesión renal aguda es un término compuesto que incluye creatinina en sangre aumentando la lesión renal insuficiencia renal de insuficiencia renal de la tasa de filtración glomerular disminuida y la nefropatía tóxica metro. Mareos es un término compuesto que incluye mareos y vértigo norte. La neuropatía periférica es un término compuesto que incluye disestesia disestesia hipoestesia neuropatía motora periférica sensación de ardor neuralgia y neuropatía sensorial periférica el. El hipotiroidismo es un término compuesto que incluye hipotiroidismo en la hormona de la tiroides de sangre aumentada y el hipotiroidismo inmunomediado pag. Las anormalidades de la prueba de función hepática son un término compuesto que incluye alanina aminotransferasa aumentando la aspartato aminotransferasa aumentando la bilirrubina conjugada con aumento de la fosfatasa alcalina en sangre aumentó la bilirrubina en la sangre y aumentó la gamma-glutamiltransferasa |
Tabla 5: Grado 3 o 4 anomalías de laboratorio empeorando desde el inicio en ≥ 1% de los pacientes con BCC avanzado que reciben Libtayo en el Estudio 1620
| Anormalidad de laboratorio | Grado 3-4 (%)a |
| Hematología | |
| 2.9 | |
| Electrolitos | |
| 2.9 | |
| 1.5 | |
| Coagulación | |
| 1.9 | |
| Toxicidad calificada por NCI CTCAE v. 4.03 a. Los porcentajes se basan en el número de pacientes con al menos 1 valor posterior a la base disponible para eso parámetro |
Cáncer de pulmón de células no pequeñas (NSCLC)
Tratamiento de primera línea de NSCLC con Libtayo en combinación con quimioterapia basada en platino
La seguridad de Libtayo en combinación con quimioterapia basada en platino se evaluó en 465 pacientes con NSCLC localmente avanzado o metastásico en el estudio 16113 [ver Estudios clínicos ] Patients received Libuta 350 mg every 3 weeks plus platinum-based quimioterapia every 3 weeks fo 4 cycles (n=312) o placebo every 3 weeks plus platinum-based quimioterapia every 3 weeks fo 4 cycles (n=153).
Entre los pacientes que recibieron Libtayo 70% fueron expuestos durante 6 meses o más y el 35% estuvieron expuestos por más de un año. Las características de la población de seguridad fueron: mediana de edad de 63 años (25 a 82 años) 41% de los pacientes 65 o más 86% masculinos 86% blanco 14% asiático 86% tenían enfermedad metastásica y el 14% tenía enfermedades localmente avanzadas y estado de rendimiento del grupo de oncología cooperativa oriental (ECOG) (PS) de 0 (16%) y 1 (83%).
Se produjeron reacciones adversas graves en el 25% de los pacientes. Las reacciones adversas graves más frecuentes que ocurrieron en al menos el 2% de los pacientes fueron la anemia de neumonía y neutropenia . Las reacciones adversas fatales ocurrieron en el 6%de los pacientes que recibieron libtayo en combinación con quimioterapia, incluida la muerte no especificada (2.9%) de muerte súbita (1.0%) hepatitis aguda (0.3%) aguda Síndrome de dificultad respiratoria (0.3%) trombosis de la arteria mesentérica (0.3%) neumonía (0.3%) neumonitis (0.3%) y hemorragia pulmonar (0.3%). Libtayo se suspendió permanentemente debido a reacciones adversas en el 5% de los pacientes. Las reacciones adversas que dieron como resultado la interrupción permanente en al menos 2 pacientes aumentaron la alanina aminotransferasa y la anemia.
Dosificación interruptions of Libuta due to an adverse reaction occurred in 33% of patients. Adverse reactions which required dosage interruptions in at least 2% of patients were anemia pneumonia neutropenia thrombocytopenia fatiga COVID-19 infection y pyrexia.
Las reacciones adversas más comunes (≥ 15%) fueron el dolor musculoesquelético de alopecia, náusea, fatiga de la neuropatía periférica y disminución del apetito. Las anormalidades de laboratorio de grado 3-4 más comunes (≥ 2%) fueron la anemia neutropenia linfopenia leucopenia hiponatremia trombocitopenia hiperglucemia hipofosfatemia aumentando la alanina aminotransferasa hipocalcemia hipermagnesemia hipocalemia y aumento de la crealcalcemia hipermagnesemia y aumento de la crealcalcemia hipermagnesemia y el aumento de la create de la creatinina.
La Tabla 6 resume las reacciones adversas que ocurrieron en ≥ 10% de los pacientes y la Tabla 7 resume las anormalidades de laboratorio de grado 3 o 4 en pacientes que reciben libtayo y quimioterapia.
Tabla 6: Reacciones adversas en ≥ 10% de los pacientes con NSCLC localmente avanzado o metastásico que reciben libtayo y quimioterapia en el estudio 16113
| Reacción adversas | Libuta y Quimioterapia (N = 312) | Placebo y quimioterapia (N = 153) | ||
| Todos los grados % | Grados 3 o 4 % | Todos los grados % | Grados 3 o 4 % | |
| Piel y trastornos del tejido subcutáneo | ||||
| 37 | 0 | 43 | 0 | |
| a | 13 | 1.3 | 6 | 0 |
| Trastornos musculoesqueléticos y de tejido conectivo | ||||
| b | 30 | 1.6 | 3.6 | 0 |
| Gastrointestinal disoders | ||||
| 25 | 0 | 16 | 0 | |
| 14 | 0.3 | 11 | 0 | |
| 12 | 0 | 10 | 0 | |
| 11 | 1.3 | 7 | 0 | |
| Trastornos generales y condiciones del sitio de administración | ||||
| c | 23 | 3.8 | 18 | 2 |
| Trastornos del sistema nervioso | ||||
| d | 23 | 0 | 19 | 0 |
| Metabolismo y trastornos nutricionales | ||||
| 17 | 1 | 12 | 0 | |
| Investigaciones | ||||
| 11 | 1.3 | 8 | 0 | |
| Respiratorio thoacic y mediastinal disoders | ||||
| e | 13 | 2.2 | 7 | 0.7 |
| Trastornos psiquiátricos | ||||
| 11 | 0 | 7 | 0 | |
| La toxicidad se calificó por criterio de terminología común del Instituto Nacional del Cáncer para eventos adversos (NCI CTCAE) v.4.03 a. La erupción es un término compuesto que incluye erupción cutánea dermatitis maculo-papular psoriasis erupción dermatitis papular dermatitis alérgica eritema alérgico liquen planus erupción cutánea macular reacción de la piel prurítica toxicidad de la piel exfoliación de la piel y dermatitis acneiforme. b. El dolor musculoesquelético es un término compuesto que incluye dolor de espalda de artralgia dolor en la extremidad Dolor en el pecho no cardíaco Myalgia Dolor hueso Dolor musculoesquelético Dolor del cuello musculoesquelético Dolor táctico Artritis y dolor espinal. do. La fatiga es un término compuesto que incluye fatiga de astenia y malestar. d. La neuropatía periférica es un término compuesto que incluye neuropatía sensorial periférica neuropatía periférica parestesia polineuropatía hipoestesia neuropatía sensorimotora periférica neuralgia polineuropatía en enfermedad maligna y neuropatía tóxica. y. La disnea es un término compuesto que incluye disnea y disnea. |
Tabla 7: Grado 3 o 4 anomalías de laboratorio empeorando desde el inicio en ≥ 1% de los pacientes con CPNMC localmente avanzada o metastásica que reciben libtayo y quimioterapia en el estudio 16113
| Anormalidad de laboratorio | Libuta y Quimioterapia | Placebo y quimioterapia |
| Grados 3 o 4 (%)a | ||
| Química | ||
| 4 | 1.5 | |
| 3 | 2.1 | |
| 2 | 1.4 | |
| 1 | 0 | |
| Hematología | ||
| 10 | 7 | |
| 10 | 8 | |
| 7 | 8 | |
| 6 | 4.1 | |
| 4.7 | 0.7 | |
| Electrolitos | ||
| 6 | 4.1 | |
| 3.4 | 7 | |
| 3 | 2.1 | |
| 2.7 | 2.7 | |
| 2.4 | 2.8 | |
| 2.3 | 1.4 | |
| 1.7 | 0.7 | |
| 1 | 0 | |
| Toxicidad calificada por NCI CTCAE v. 4.03 a El denominador solía calcular la tasa varió de 134 a 299 en función del número de pacientes con un valor de referencia y al menos un valor posterior al tratamiento. |
Tratamiento de primera línea de NSCLC con Libtayo como agente único
La seguridad de Libtayo se evaluó en 355 pacientes con NSCLC localmente avanzado o metastásico en el estudio 1624 [ver Estudios clínicos ] Patients received Libuta 350 mg every 3 weeks (n=355) o investigato’s choice of quimioterapia (n=342) consisting of paclitaxel plus cisplatin o carboplatin; gemcitabine plus cisplatin o carboplatin; o pemetrexed plus cisplatin o carboplatin followed by optional pemetrexed maintenancy. The median duration of exposure was 27.3 weeks (9 days to 115 weeks) in the Libuta group y 17.7 weeks (18 days to 86.7 weeks) in the quimioterapia groupag. In the Libuta group 54% of patients were exposed to Libuta fo ≥ 6 months y 22% were exposed fo ≥ 12 months.
Las características de la población de seguridad fueron: edad media de 63 años (31 a 79 años) 44% de los pacientes 65 o más 88% masculino 86% blanco 82% tenían enfermedad metastásica y el 18% tenía una enfermedad de rendimiento de ECOG localmente avanzada (PS) de 0 (27%) y 1 (73%).
Libuta was permanently discontinued due to adverse reactions in 6% of patients; adverse reactions resulting in permanent discontinuation in at least 2 patients were pneumonitis pneumonia ischemic stroke y increased aspartate aminotransferasy. Serious adverse reactions occurred in 28% of patients. The most frequent serious adverse reactions in at least 2% of patients were pneumonia y pneumonitis.
La Tabla 8 resume las reacciones adversas que ocurrieron en ≥ 10% de los pacientes y la Tabla 9 resume las anormalidades de laboratorio de grado 3 o 4 en pacientes que reciben Libtayo.
Tabla 8: Reacciones adversas en ≥ 10% de los pacientes con NSCLC localmente avanzado o metastásico que reciben libtayo en el estudio 1624
| Reacción adversas | Libuta N = 355 | Quimioterapia N = 342 | ||
| Todos los grados % | Grados 3-4 % | Todos los grados % | Grados 3-4 % | |
| Trastornos musculoesqueléticos y de tejido conectivo | ||||
| a | 26 | 0.6 | 27 | 1.5 |
| Piel y trastornos del tejido subcutáneo | ||||
| b | 15 | 1.4 | 6 | 0 |
| Trastornos de la sangre y el sistema linfático | ||||
| 15 | 3.4 | 50 | 1.6 | |
| Trastornos generales y condiciones del sitio de administración | ||||
| c | 14 | 1.1 | 26 | 2 |
| Metabolismo y trastornos nutricionales | ||||
| 12 | 0.6 | 18 | 0.3 | |
| Infecciones e infestaciones | ||||
| d | 11 | 5 | 12 | 5 |
| Respiratorio thoacic y mediastinal disoders | ||||
| e | 11 | 0 | 8 | 0.3 |
| La toxicidad se calificó por criterio de terminología común del Instituto Nacional del Cáncer para eventos adversos (NCI CTCAE) v.4.03 a. El dolor musculoesquelético es un término compuesto que incluye dolor de espalda artralgia dolor en la extremidad dolor musculoesquelético b. Erupción es un término compuesto que incluye dermatitis de erupción urticaria eritema maculo-potular dermatitis dermatitis dermatitis dermatitis alérgica dermatitis dermatitis dermatitis drofármaco do. La fatiga es un término compuesto que incluye astenia por fatiga y malestar d. La neumonía es un término compuesto que incluye neumonía atípica neumonía embólica infección del tracto respiratorio inferior pulmón pulmonar paracancerante neumonía neumonía neumonía bacteriana y neumonía klebsiella y. La tos es un término compuesto que incluye tos y tos productiva |
Tabla 9: Grado 3 o 4 anomalías de laboratorio empeorando desde el inicio en ≥1% de los pacientes con NSCLC localmente avanzado o metastásico que reciben libtayo en el estudio 1624
| Anormalidad de laboratorio | Libuta N = 355 | Quimioterapia N = 342 |
| Grados 3-4a % | ||
| Química | ||
| 3.9 | 1.2 | |
| 2.7 | 0.3 | |
| 2.4 | 0.3 | |
| 2.1 | 0.3 | |
| 1.8 | 1.3 | |
| 1.2 | 1.6 | |
| Hematología | ||
| 7 | 9 | |
| 2.7 | 16 | |
| Electrolitos | ||
| 6 | 7 | |
| 4.2 | 1.9 | |
| 3.9 | 3.4 | |
| 2.4 | 4.1 | |
| 2.1 | 1.6 | |
| 1.5 | 2.2 | |
| 1.2 | 2.2 | |
| Toxicidad calificada por NCI CTCAE v. 4.03 a Los porcentajes se basan en el número de pacientes con al menos 1 valor posterior a la base disponible para ese parámetro. |
Interacciones de drogas para Libtayo
No se proporciona información
Advertencias para libtayo
Incluido como parte del 'PRECAUCIONES' Sección
Precauciones para libtayo
Reacciones adversas inmunomediadas graves y fatales
Libuta is a monoclonal antibody that belongs to a class of drugs that bind to either the programmed death recepto-1 (PD-1) o PD-ligy 1 (PD-L1) blocking the PD-1/PD-L1 pathway thereby removing inhibition of the immune response potentially breaking peripheral tolerance y inducing immune-mediated adverse reactions. Impotant immune-mediated adverse reactions listed under Warnings y Precautions may not include all possible severe y fatal immune-mediated reactions.
La incidencia y la gravedad de las reacciones adversas mediadas por inmunomediadas fueron similares cuando Libtayo se administró como un solo agente o en combinación con quimioterapia.
Las reacciones adversas mediadas por inmunomediadas que pueden ser graves o fatales pueden ocurrir en cualquier sistema o tejido de órganos. Las reacciones adversas mediadas por inmunomediadas pueden ocurrir en cualquier momento después de iniciar el anticuerpo de bloqueo PD-1/PD-L1. Mientras que las reacciones adversas mediadas por inmunomediadas generalmente se manifiestan durante el tratamiento con anticuerpos de bloqueo PD-1/PD-L1 de bloqueo inmunomedico también pueden manifestarse después de la interrupción de los anticuerpos de bloqueo PD-1/PD-L1. Las reacciones adversas mediadas por inmunomediadas que afectan a más de un sistema corporal pueden ocurrir simultáneamente.
La identificación temprana y el manejo de las reacciones adversas mediadas por inmunomune son esenciales para garantizar el uso seguro de los anticuerpos de bloqueo PD-1/PD-L1. Monitoree de cerca los síntomas y signos que pueden ser manifestaciones clínicas de reacciones adversas subyacentes mediadas por inmunomediadas. Evalúe la función de creatinina y tiroides de las enzimas hepáticas al inicio y periódicamente durante el tratamiento. En casos de sospechas de reacciones adversas inmunomediadas inician un trabajo apropiado para excluir etiologías alternativas, incluida la infección. Instituto Medical Management Inclute de inmediato la consulta de especialidad según corresponda.
Retener o permanently discontinue Libuta depending on severity [ver Dosis y administración ] In general if Libuta requires interruption o discontinuation administer systemic coticosteroid therapy (1 to 2 mg/kg/day prednisone o equivalent) until improvement to Grade 1 o less. Upon improvement to Grade 1 o less initiate coticosteroid taper y continue to taper over at least 1 month. Consider administration of other systemic immunosuppressants in patients whose immune-mediated adverse reactions are not controlled with coticosteroids.
Las pautas de gestión de toxicidad para las reacciones adversas que no necesariamente requieren esteroides sistémicos (por ejemplo, endocrinopatías y reacciones dermatológicas) se analizan a continuación.
Neumonitis por inmunidad
Libuta can cause immune-mediated pneumonitis. The definition of immune-mediated pneumonitis included the required use of systemic coticosteroids o other immunosuppressants y the absence of a clear alternate etiology. In patients treated with other PD-1/PD-L1 blocking antibodies the incidence of pneumonitis is higher in patients who have received prio thoacic radiationorte.
La neumonitis mediada por inmunomediada se produjo en el 2.6%(33/1281) de los pacientes que recibieron Libtayo, incluidos reacciones adversas de grado 4 (0.3%) de grado 3 (0.6%) y grado 2 (1.6%). La neumonitis condujo a la interrupción permanente de Libtayo en el 1.3% de los pacientes y la retención de Libtayo en el 1.4% de los pacientes.
Se requirieron corticosteroides sistémicos en todos los pacientes con neumonitis. La neumonitis se resolvió en el 61% de los 33 pacientes. De los 18 pacientes en los que Libtayo fue retenido por la neumonitis 10 reiniciado de Libtayo después de la mejora de los síntomas; De estos 4/10 (40%) tuvieron recurrencia de neumonitis.
Colitis inmunitaria
Libuta can cause immune-mediated colitis. The definition of immune-mediated colitis included the required use of systemic coticosteroids o other immunosuppressants y the absence of a clear alternate etiology. The primary component of the immune-mediated colitis was diarrea. Cytomegalovirus (CMV) infection/reactivation has been repoted in patients with coticosteroid-refractoy immune-mediated colitis treated with PD-1/PD-L1 blocking antibodies. In cases of coticosteroid-refractoy colitis consider repeating infectious wokup to exclude alternative etiologies.
La colitis mediada por inmunomediada se produjo en el 2%(25/1281) de los pacientes que recibieron libtayo, incluidas reacciones adversas de grado 3 (0.8%) y grado 2 (0.9%). La colitis condujo a la interrupción permanente de Libtayo en el 0,4% de los pacientes y la retención de Libtayo en el 1.2% de los pacientes.
Se requirieron corticosteroides sistémicos en todos los pacientes con colitis. Colitis resuelta en el 56% de los 25 pacientes. De los 16 pacientes en los que Libtayo fue retenido por la colitis 6 reiniciado de Libtayo después de la mejora de los síntomas; De estos 4/6 (67%) tuvieron recurrencia de colitis.
Hepatitis inmunomediada
Libuta can cause immune-mediated hepatitis. The definition of immune-mediated hepatitis included the required use of systemic coticosteroids o other immunosuppressants y the absence of a clear alternate etiology.
La hepatitis mediada por inmunomediada se produjo en el 2,4% (31/1281) de los pacientes que recibieron libtayo, incluidos fatales (fatales (<0.1%) Grado 4 (0.3%) Grade 3 (1.6%) y Grado 2 (0.2%) adverse reactions.
La hepatitis condujo a la interrupción permanente de Libtayo en el 1,4% de los pacientes y la retención de Libtayo en el 0,7% de los pacientes.
Se requirieron corticosteroides sistémicos en todos los pacientes con hepatitis. Trece por ciento (13%) de estos pacientes (4/31) requirieron inmunosupresión adicional con micofenolato. La hepatitis se resolvió en el 39% de los 31 pacientes. De los 9 pacientes en los que se retuvo Libtayo para los pacientes con hepatitis 5 reiniciado de Libtayo después de la mejora de los síntomas; De estos 1/5 (20%) tuvieron recurrencia de hepatitis.
Endocrinopatías inmunes
Insuficiencia suprarrenal
Libuta can cause primary o secondary adrenal insufficiency. Fo Grado 2 o higher adrenal insufficiency initiate symptomatic treatment including homone replacement as clinically indicated. Retener Libuta depending on severity [ver Dosis y administración ]
La insuficiencia suprarrenal ocurrió en 0.5% (6/1281) de pacientes que recibieron Libtayo, incluidas las reacciones adversas de grado 3 (0.5%). La insuficiencia suprarrenal condujo a la interrupción permanente de Libtayo en 1 (<0.1%) patient. Libuta was withheld in 1 (< 0.1%) patient due to adrenal insufficiency y not reinitiated. Systemic coticosteroids were required in 83% (5/6) patients with adrenal insufficiency; of these the majoity remained on systemic coticosteroids. Adrenal insufficiency resolved in 17% of the 6 patients.
Hipofisitis
Libuta can cause immune-mediated hypophysitis. Hipofisitis can present with acute symptoms associated with mass effect such as headache photophobia o visual field defects. Hipofisitis can cause hypopituitarismetro. Initiate homone replacement as clinically indicated. Retener o permanently discontinue Libuta depending on severity [ver Dosis y administración ]
Hipofisitis occurred in 0.5% (7/1281) of patients receiving Libuta including Grade 3 (0.2%) y Grado 2 (0.3%) adverse reactions. Hipofisitis led to permanent discontinuation of Libuta in 1 (<0.1%) patient y withholding of Libuta in 2 (0.2%) patients. Systemic coticosteroids were required in 86% (6/7) patients with hypophysitis. Hipofisitis resolved in 14% of the 7 patients. Of the 2 patients in whom Libuta was withheld fo hypophysitis none of the patients reinitiated.
Trastornos de la tiroides
Libuta can cause immune-mediated thyroid disoders. Tiroiditis can present with o without endocrinopathy. Hipotiroidismo can follow hyperthyroidismetro. Initiate homone replacement o medical management of hyperthyroidism as clinically indicated. Retener o permanently discontinue Libuta depending on severity [ver Dosis y administración ]
Tiroiditis
Tiroiditis occurred in 0.6% (8/1281) of patients receiving Libuta including Grado 2 (0.3%) adverse reactions. No patient discontinued Libuta due to thyroiditis. Tiroiditis led to withholding of Libuta in 1 (<0.1%) patient. Systemic coticosteroids were not required in any patient with thyroiditis. Tiroiditis resolved in 13% of the 8 patients.
La hormona estimulante de la tiroides en sangre aumentó y también se ha informado la hormona estimulante de la tiroides en sangre.
Hipertiroidismo
Hipertiroidismo occurred in 3% (39/1281) of patients receiving Libuta including Grade 3 (<0.1%) y Grado 2 (0.9%) adverse reactions. No patient discontinued treatment due to hyperthyroidismetro. Hipertiroidismo led to withholding of Libuta in 7 (0.5%) patients.
Se requirieron corticosteroides sistémicos en el 8% (3/39) de pacientes con hipertiroidismo. El hipertiroidismo se resolvió en el 56% de los 39 pacientes. De los 7 pacientes en los que se retuvo Libtayo por hipertiroidismo 2 pacientes reiniciados de Libtayo después de la mejora de los síntomas; De estos ninguno tenía recurrencia de hipertiroidismo.
Hipotiroidismo
Hipotiroidismo occurred in 7% (87/1281) of patients receiving Libuta including Grade 3 (<0.1%) y Grado 2 (6%) adverse reactions. Hipotiroidismo led to permanent discontinuation of Libuta in 3 (0.2%) patients. Hipotiroidismo led to withholding of Libuta in 9 (0.7%) patients.
Se requirieron corticosteroides sistémicos en el 1.1% (1/87) de los pacientes. El hipotiroidismo se resolvió en el 6% de los 87 pacientes. La mayoría de los pacientes con hipotiroidismo requirieron reemplazo de hormona tiroidea a largo plazo.
De los 9 pacientes en los que Libtayo fue retenido por el hipotiroidismo 1 reiniciado de Libtayo después de la mejora de los síntomas y no tuvo recurrencia de hipotiroidismo.
Diabetes mellitus tipo 1 que puede presentarse con cetoacidosis diabética.
Monitoree a los pacientes con hiperglucemia u otros signos y síntomas de diabetes. Inicie el tratamiento con insulina como se indica clínicamente. Retener a Libtayo dependiendo de la gravedad [ver Dosis y administración ]
Diabetes mellitus tipo 1 ocurrió en <0.1% (1/1281) of patients (Grado 4). No patient discontinued treatment due to Type 1 diabetes mellitus. Type 1 diabetes mellitus led to withholding of Libuta in 0.1% of patients treatment was reinitiated after symptom improvement. Patient received long-term insulin therapy.
Nefritis mediada por inmunir con disfunción renal
Libuta can cause immune-mediated nephritis. The definition of immune-mediated nephritis included the required use of systemic coticosteroids o other immunosuppressants y the absence of a clear alternate etiology.
La nefritis mediada por inmunomediada se produjo en 0.7% (9/1281) pacientes que recibieron libtayo, incluidos fatales (fatales (<0.1%) Grade 3 (< 0.1%) y Grado 2 (0.5%) adverse reactions. Nephritis led to permanent discontinuation of Libuta in 0.2% of patients y withholding of Libuta in 0.4% of patients.
Se requirieron corticosteroides sistémicos en todos los pacientes con nefritis. La nefritis se resolvió en el 78% de los 9 pacientes. De los 5 pacientes en los que Libtayo fue retenido por la nefritis 4 reiniciado de Libtayo después de la mejora de los síntomas; De estos 1/4 (25%) tuvieron recurrencia de nefritis.
Reacciones adversas dermatológicas mediadas por inmunomuneal
Libuta can cause immune-mediated erupción o dermatitis. The definition of immune-mediated dermatologic adverse reaction included the required use of systemic coticosteroids o other immunosuppressants y the absence of a clear alternate etiology. Exfoliative dermatitis including Stevens-Johnson Syndrome (SJS) toxic epidermal necrolysis (TEN) y DRESS (Drug Rash with Eosinophilia y Systemic Symptoms) has occurred with PD-1/PD-L1 blocking antibodies. Topical emollients y/o topical coticosteroids may be adequate to treat mild to moderate non-exfoliative erupciónes. Retener o permanently discontinue Libuta depending on severity [ver Dosis y administración ]
Las reacciones adversas dermatológicas mediadas por inmunomediadas se produjeron en el 1.9%(24/1281) de los pacientes que recibieron libtayo, incluidas reacciones adversas de grado 3 (0.9%) y grado 2 (0.8%). Las reacciones adversas dermatológicas condujeron a la interrupción permanente de Libtayo en el 0.2% de los pacientes y la retención de Libtayo en el 1.3% de los pacientes.
Se requirieron corticosteroides sistémicos en todos los pacientes con reacciones adversas dermatológicas inmunomediadas. Reacciones adversas dermatológicas mediadas por inmunomediadas resueltas en el 71% de los 24 pacientes. De los 17 pacientes en los que Libtayo fue retenido para la reacción adversa dermatológica 13 reiniciado Libtayo después de la mejora de los síntomas; De estos 5/13 (38%) tuvieron recurrencia de la reacción adversa dermatológica.
Otras reacciones adversas mediadas por inmunir
Las siguientes reacciones adversas inmunomediadas clínicamente significativas se produjeron en una incidencia de <1% in 1281 patients who received Libuta o were repoted with the use of other PD-1/PD-L1 blocking antibodies. Severe o fatal cases have been repoted fo some of these adverse reactions.
Cardíaco/vascular: Miocarditis pericarditis vasculitis
Sistema nervioso: Meningitis encefalitis mielitis y desmielinización Síndrome de miasténico/miastenia gravis (incluida la exacerbación) Síndrome de Guillain Barre Nervio Paresis neuropatía autoinmune
Ocular: Uveítis iritis y otras toxicidades inflamatorias oculares. Algunos casos pueden estar asociados con desprendimiento de retina. Pueden ocurrir varios grados de discapacidad visual para incluir ceguera. Si la uveítis ocurre en combinación con otras reacciones adversas mediadas inmunomediadas, considere un síndrome de Vogt-Koyanagi-Harada, ya que esto puede requerir tratamiento con esteroides sistémicos para reducir el riesgo de pérdida de visión permanente.
Gastrointestinal: Pancreatitis para incluir aumentos en la estomatitis de duodenitis de la gastritis de la amilasa y lipasa
Tejido musculoesquelético y conectivo: Miositis/polimiositis/dermatomiositis -rabdomiólisis y secuelas asociadas que incluyen insuficiencia renal artritis polimialgia reumatica
Anusol HC 1 sin receta
Endocrino: Hipoparatiroidismo
Otro (hematológico/inmune): Anemia hemolítica Anemia aplásica Linfagocítica Hemofoistiocitosis Síndrome de respuesta inflamatoria sistémica linfadenitis necrotizante histiocítica (linfadenitis de Kikuchi) sarcoidosis trombocitopenia trasplante de órgano sólido rechazo de otro trasplante de otro trasplante (injerto corneal) rechazo
Reacciones relacionadas con la infusión
Las reacciones graves o potencialmente mortales relacionadas con la infusión ocurrieron en el 0.2% de los pacientes que recibieron Libtayo como agente único. Monitoree a los pacientes los signos y síntomas de reacciones relacionadas con la infusión. Los síntomas comunes de la reacción relacionada con la infusión incluyen náuseas pyrexia y vómitos.
Interrumpir o ralentizar la tasa de infusión o permanently discontinue Libuta based on severity of reaction [ver Dosis y administración ]
Complicaciones de HSCT alogénico
Las complicaciones graves fatales y otras pueden ocurrir en pacientes que reciben trasplante alogénico de células madre hematopoyéticas (HSCT) antes o después de ser tratados con un anticuerpo de bloqueo PD-1/PD-L1. Las complicaciones relacionadas con el trasplante incluyen el injerto hiperacute-versus-huésped-desacuñado (GVHD) GVHD GVHD Enfermedad hepática hepática (VOD) después de un acondicionamiento de intensidad reducido y un síndrome febril febril que requería esteroides (sin una causa infecciosa identificada). Estas complicaciones pueden ocurrir a pesar de la terapia intermedia entre el bloqueo PD-1/PD-L1 y el HSCT alogénico.
Siga a los pacientes de cerca para obtener evidencia de complicaciones relacionadas con el trasplante e intervenga de inmediato. Considere el beneficio versus los riesgos del tratamiento con un anticuerpo de bloqueo PD-1/PD-L1 antes o después de un HSCT alogénico.
Toxicidad embrionaria
Basado en su mecanismo de acción, Libtayo puede causar daño fetal cuando se administra a una mujer embarazada. Los estudios en animales han demostrado que la inhibición de la vía PD-1/PD-L1 puede conducir a un mayor riesgo de rechazo inmune mediado del feto en desarrollo, lo que resulta en la muerte fetal. Aconsejar a las mujeres sobre el riesgo potencial para un feto. Asesorar a las mujeres del potencial reproductivo para usar una anticoncepción efectiva durante el tratamiento con Libtayo y durante al menos 4 meses después de la última dosis [ver Uso en poblaciones específicas ]
Información de asesoramiento de pacientes
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA ( Guía de medicación ).
Reacciones adversas mediadas por inmunir
Aconseje a los pacientes que Libtayo puede causar reacciones adversas inmunomediadas, incluidas las siguientes Advertencias y precauciones ]
- Neumonitis: Advise patients to contact their healthcare provider immediately fo signs o symptoms of pneumonitis including new o wosening symptoms of cough dolor en el pecho o dificultad para respirar.
- Colitis: Advise patients to contact their healthcare provider immediately fo signs o symptoms of colitis including diarrea blood o mucus in stools o severe abdominal painorte.
- Hepatitis: aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato para obtener signos o síntomas de hepatitis.
- Endocrinopatías: Advise patients to contact their healthcare provider immediately fo signs o symptoms of hypothyroidism hyperthyroidism adrenal insufficiency hypophysitis o type 1 diabetes mellitus.
- Nefritis: aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato para obtener signos o síntomas de nefritis.
- Reacciones adversas dermatológicas: aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato si desarrollan una nueva erupción.
Reacciones relacionadas con la infusión
Aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato para obtener signos o síntomas de reacciones relacionadas con la infusión [ver Advertencias y precauciones ]
Complicaciones de HSCT alogénico Or Solid Organ Transplant Rejection
Aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato si desarrollan signos o síntomas de complicaciones HSCT post-alogénicas o de rechazo de trasplante de órganos sólidos [ver Advertencias y precauciones ]
Toxicidad embrionaria
Asegúrese de que las hembras del potencial reproductivo puedan causar daño a un feto e informar a su proveedor de atención médica de un embarazo conocido o sospechoso [ver Advertencias y precauciones y Uso en poblaciones específicas ]
Asesorar a las mujeres del potencial reproductivo para usar una anticoncepción efectiva durante el tratamiento y durante al menos 4 meses después de la última dosis de Libtayo [ver Uso en poblaciones específicas ]
Lactancia
Aconsejan a las pacientes femeninas que no amamanten mientras toman libtayo y durante al menos 4 meses después de la última dosis [ver Uso en poblaciones específicas ]
Toxicología no clínica
Carcinogénesis Mutagénesis Deterioro de la fertilidad
No se han realizado estudios para evaluar el potencial de cemiplimab-RWLC para la carcinogenicidad o la genotoxicidad.
En un estudio de toxicología de dosis de repetición de 3 meses en monos Cynomolgus sexualmente maduros, no hubo efectos relacionados con cemiplimab-RWLC en los parámetros de fertilidad (análisis de semen del ciclo menstrual o mediciones testiculares) o en los órganos reproductivos masculinos o femeninos con dosis de hasta la dosis más altas probadas 50 MG/kg/semana (aproximadamente 5.5 a 5.5 a los 5.5.5.5.5 veces la expulsión de la semana en la dosis de la dosis más altas (aproximadamente 5.5 de la semana. en la dosis clínica de 350 mg una vez cada 3 semanas).
Uso en poblaciones específicas
Embarazo
Resumen de riesgos
Basado en su mecanismo de acción, Libtayo puede causar daño fetal cuando se administra a una mujer embarazada [ver Farmacología clínica ] There are no available data on the use of Libuta in pregnant womenorte. Animal studies have demonstrated that inhibition of the PD-1/PD-L1 pathway can lead to increased risk of immune-mediated rejection of the developing fetus resulting in fetal death (see Datos ). Human IgG4 immunoglobulins (IgG4) are known to cross the placenta; therefoe Libuta has the potential to be transmitted from the mother to the developing fetus. Advise women of the potential risk to a fetus.
En la población general de los EE. UU., El riesgo de antecedentes estimado de los principales defectos de nacimiento y el aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20% respectivamente.
Datos
Datos animales
Los estudios de reproducción animal no se han realizado con Libtayo para evaluar su efecto sobre la reproducción y el desarrollo fetal. Una función central de la vía PD-1/PD-L1 es preservar el embarazo manteniendo la tolerancia inmune materna al feto. En los modelos murinos de bloqueo de embarazo de la señalización PD-L1 se ha demostrado que interrumpe la tolerancia al feto y resulta en un aumento en la pérdida fetal; Por lo tanto, los riesgos potenciales de administrar Libtayo durante el embarazo incluyen mayores tasas de aborto o muerte fetal. Como se informó en la literatura, no hubo malformaciones relacionadas con el bloqueo de la señalización PD-1/PD-L1 en la descendencia de estos animales; Sin embargo, los trastornos inmunomediados ocurrieron en ratones knockout PD-1 y PD-L1. Basado en su mecanismo de acción, la exposición fetal a cemiplimab-RWLC puede aumentar el riesgo de desarrollar trastornos inmunomediados o alterar la respuesta inmune normal.
Lactancia
Resumen de riesgos
No hay información sobre la presencia de cemiplimab-RWLC en la leche humana o sus efectos en el niño amamantado o en la producción de leche. Debido al potencial de reacciones adversas graves en los niños amamantados, aconsejar a las mujeres que no amamanten durante el tratamiento y durante al menos 4 meses después de la última dosis de Libtayo.
Hembras y machos de potencial reproductivo
Embarazo Testing
Verifique el estado del embarazo en mujeres de potencial reproductivo antes de iniciar Libtayo [ver Embarazo ]
Anticoncepción
Libuta can cause fetal harm when administered to a pregnant woman [ver Embarazo ]
Hembras
Aconsejar a las mujeres del potencial reproductivo para usar una anticoncepción efectiva durante el tratamiento con Libtayo y durante al menos 4 meses después de la última dosis.
Uso pediátrico
La seguridad y la efectividad de Libtayo no se han establecido en pacientes pediátricos.
Uso geriátrico
Libuta As A Single Agent
De los 1281 pacientes que recibieron Libtayo como agente único en estudios clínicos, 26% fueron 65 años hasta 75 años y 22% fueron 75 años o más. No se observaron diferencias generales en seguridad o efectividad entre estos pacientes y los pacientes más jóvenes.
De los 358 pacientes con MCSCC o LACSCC que recibieron Libtayo como agente único en el estudio 1540 30% fueron 65 años hasta 75 años y 48% fueron 75 años o más. No se observaron diferencias generales en seguridad o efectividad entre estos pacientes y los pacientes más jóvenes.
De los 138 pacientes con BCC que recibieron Libtayo como agente único en el estudio 1620 27% fueron 65 años hasta 75 años y el 31% fueron 75 años o más. No se observaron diferencias generales en seguridad o efectividad entre estos pacientes y los pacientes más jóvenes.
Libuta In Combination With Platinum-Based Quimioterapia
De los 312 pacientes con NSCLC que recibieron libtayo en combinación con quimioterapia basada en platino en el Estudio 16113 35% fueron 65 años hasta 75 años y el 6% fueron 75 años o más. No se observaron diferencias generales en seguridad o efectividad entre estos pacientes y los pacientes más jóvenes.
Información de sobredosis para Libtayo
No se proporciona información
Contraindicaciones para Libtayo
Ninguno.
Farmacología clínica fo Libtayo
Mecanismo de acción
La unión de los ligandos PD-1 PD-L1 y PD-L2 al receptor PD-1 encontrado en las células T inhibe la proliferación de células T y la producción de citocinas. La regulación positiva de los ligandos PD-1 ocurre en algunos tumores y la señalización a través de esta vía puede contribuir a la inhibición de la vigilancia inmune de las células T activas de los tumores.
Cemiplimab-RWLC es un anticuerpo monoclonal de inmunoglobulina humano G4 (IgG4) recombinante que se une a PD-1 y bloquea su interacción con la inhibición PD-L1 y PD-L2 que libera la inhibición de la vía PD-1 de la respuesta inmune, incluida la respuesta inmune antitumoral. En los modelos tumorales singénicos que bloquean la actividad de PD-1 dieron como resultado una disminución del crecimiento tumoral.
Farmacodinámica
Las relaciones con exposición de cemiplimab y el curso temporal de la respuesta farmacodinámica no se caracterizan por completo.
Farmacocinética
Se recopilaron datos farmacocinéticos Cemiplimab-RWLC en 1063 pacientes con varios tumores sólidos. La farmacocinética de Cemiplimab-RWLC fue lineal y proporcional en el rango de dosis de 1 mg/kg a 10 mg/kg de libtayo administrado por vía intravenosa cada 2 semanas.
A 350 mg cada 3 semanas, las concentraciones medias de cemiplimab-RWLC (coeficiente de variación CV%) a un estado estacionario varían entre una concentración mínima de 59 mg/L (47%) y una concentración máxima de 171 mg/L (27%). La exposición al estado estacionario se logra después de 4 meses de tratamiento.
En pacientes con CSCC Cemiplimab-RWLC, la exposición al estado estacionario a 350 mg cada 3 semanas era comparable a la exposición a 3 mg/kg cada 2 semanas.
Distribución
El volumen de distribución de cemiplimab-RWLC en estado estacionario es de 5.9 L (29%).
Eliminación
El aclaramiento de cemiplimab-RWLC (CV%) después de la primera dosis es de 0.25 l/día (41%) y disminuye con el tiempo en un 11%, lo que resulta en un aclaramiento de estado estacionario (CLS) (CV%) de 0.22 L/día (44%). La vida media de eliminación (CV%) en estado estacionario es de 22 días (42%).
Poblaciones específicas
Los siguientes factores no tienen un efecto clínicamente importante sobre la exposición de cemiplimab-RWLC en 1063 pacientes: edad (27 a 96 años) Peso corporal sexual (31 a 172 kg) Nivel de albúmina de tipo de cáncer (20 a 93 g/L) Función renal (eliminación de creatinina determinada por Cockcroft-Gault 21 ml/Min o mayor) y función Hepatic (total bilirubin mayor que 1.0 veces hasta 3.0 veces hasta 3.0 veces hasta 3.0 veces. La raza [blanco (n = 932) asiático (n = 47) negro (n = 21)] parece no tener un efecto clínicamente importante en la exposición de cemiplimab-rwlc. Libtayo no se ha estudiado en pacientes con discapacidad hepática grave (bilirrubina total mayor que 3.0 veces el Uln).
Inmunogenicidad
La incidencia observada de anticuerpos antidrogas depende en gran medida de la sensibilidad y la especificidad del ensayo. Las diferencias en los métodos de ensayo impiden comparaciones significativas de la incidencia de anticuerpos antidrogas en los estudios descritos a continuación con la incidencia de anticuerpos antidrogas en otros estudios, incluidos los de cemiplimab-rwlc o de otros productos de cemiplimab.
Durante el período de tratamiento que varía de 8 a 19 meses en 5 estudios clínicos, la incidencia de anticuerpos anti-cemiplimab-RWLC en pacientes tratados con libtayo fue del 2% (22/1029).
No hubo un efecto clínicamente significativo identificado de los anticuerpos anti-cemiplimab-RWLC en PK de Libtayo durante la duración del tratamiento que varía de 8 meses a 19 meses. Debido a la baja ocurrencia de anticuerpos antidrogas, se desconoce el efecto de estos anticuerpos sobre la seguridad farmacodinámica y/o la efectividad de Libtayo.
Toxicología animal y/o farmacología
En modelos animales, la inhibición de la señalización PD-L1/PD-1 aumentó la gravedad de algunas infecciones y respuestas inflamatorias mejoradas. M. tuberculosis –Los ratones knockout PD-1 infectados exhiben una supervivencia notablemente disminuida en comparación con los controles de tipo salvaje que se correlacionaron con una mayor proliferación bacteriana y respuestas inflamatorias en estos animales. Los ratones knockout PD-L1 y PD-1 y los ratones que reciben anticuerpo de bloqueo PD-L1 también han demostrado una disminución de la supervivencia después de la infección con el virus de la coriomeningitis linfocítica.
Estudios clínicos
Carcinoma de células escamosas cutáneas (CSCC)
La eficacia de Libtayo en pacientes con carcinoma de células escamosas metastásicas (nodales o distantes) (MCSCC) o CSCC localmente avanzado (LACSCC) que no fueron candidatos para cirugía curativa o radiación curativa se evaluaron en dos estudios de múltiples múltiples abiertos no aleatorios: estudio 1423 (NCT02383212). (NCT02760498). Ambos estudios excluyeron a los pacientes con enfermedad autoinmune que requirieron terapia sistémica con agentes inmunosupresores en 5 años; Historia del trasplante de órganos sólidos; tratamiento previo con anticuerpos de bloqueo anti-PD-1/PD-L1 u otro terapia de inhibidores del punto de control inmune; infección con hepatitis B del VIH o hepatitis C; o ECOG PS ≥ 2.
Los pacientes recibieron Libtayo 3 mg/kg por vía intravenosa cada 2 semanas durante hasta 48 semanas en el estudio 1423 o hasta 96 semanas (grupos 1 y 2) o 350 mg cada 3 semanas durante hasta 54 semanas (Grupo 3) en el Estudio 1540. El tratamiento continuó hasta la progresión de la enfermedad toxicidad inaceptable o la finalización del tratamiento planificado. Las evaluaciones de respuesta tumoral se realizaron cada 8 o 9 semanas. Las principales medidas de resultado de eficacia se confirmaron la tasa de respuesta objetiva (ORR) definida como respuesta completa (CR) más respuesta parcial (PR) según lo evaluado por la revisión central independiente (ICR) y la duración de la respuesta evaluada por ICR (DOR). Para los pacientes con MCSCC sin lesiones objetivo visibles externamente, ORR se determinó mediante criterios de evaluación de respuesta en tumores sólidos (Recist 1.1). Para los pacientes con lesiones objetivo visibles externamente (LACSCC y MCSCC) ORR se determinó mediante un punto final compuesto que integró las evaluaciones de ICR de datos radiológicos (Recist 1.1) y la fotografía médica digital (criterios de la OMS).
Estudio 1540
En el análisis de eficacia de 193 pacientes con CSCC avanzado inscritos en el Estudio 1540 que recibió Libtayo a 3 mg/kg cada 2 semanas o 350 mg cada tres semanas, 115 tenían MCSCC y 78 tenían LACSCC. La mediana de edad fue de 72 años (38 a 96 años); El 83% eran hombres; El 97% eran blancos 2% eran asiáticos 1% eran negros o afroamericanos y el 1% eran desconocidos de la raza; El 45% tenía ECOG PS 0 y 55% tenía ECOG PS 1; El 34% recibió al menos una terapia sistémica anticancerígena anterior; El 81% recibió cirugía previa relacionada con el cáncer; y el 68% recibió radioterapia previa. Entre los pacientes con MCSCC 77% tenían metástasis distantes y el 23% solo tenían metástasis nodales.
Para los pacientes que respondieron presentados en la Tabla 10 por debajo del tiempo mediano de respuesta fue de 2.1 meses (rango: 1.7 a 22.8 meses).
Los resultados de eficacia basados en el análisis final del Estudio 1540 se presentan en la Tabla 10.
Tabla 10: Resultados de eficacia para el estudio 1540 en CSCC
| Puntos finales de eficaciaa | CSCC metastásico Libtayo 3 mg/kg cada 2 semanas (Grupo 1) | CSCC localmente avanzado Libtayo 3 mg/kg cada 2 semanas (Grupo 2) | CSCC metastásico Libtayo 350 mg cada 3 semanas (Grupo 3) | CSCC combinado |
| N = 59 | N = 78 | N = 56 | N = 193 | |
| Tasa de respuesta objetiva confirmada (ORR) (%) | ||||
| 51 (37 64) | 45 (34 57) | 46 (33 60) | 47 (40 54) | |
| b | 20 | 13 | 20 | 17 |
| 31 | 32 | 7 | 30 | |
| Duración de la respuesta (DOR) | ||||
| Número de respondedores | N = 30 | N = 35 | N = 26 | N = 91 |
| Mediana dor en mesesc (Rango) | No (2.8 - 38.9) | 42 (1.9 - 54.6) | 41 (4.2 - 46.3) | 41 (1.9 - 54.6) |
| Pacientes con DOR observado ≥ 6 meses n (%)d | 28 (93%) | 31 (89%) | 25 (96%) | 84 (92%) |
| Pacientes con DOR observado ≥ 12 meses n (%)d | 23 (77%) | 24 (69%) | 23 (88%) | 70 (77%) |
| CI: intervalo de confianza; NR: No alcanzado a Duración mediana del seguimiento: MCSCC 3 mg/kg cada 2 semanas: 18.5 meses; LACSCC 3 mg/kg cada 2 semanas: 15.5 meses; MCSCC 350 mg cada 3 semanas: 17.3 meses; CSCC combinado: 15.7 meses b Solo incluye pacientes con curación completa de afectación cutánea previa; Los pacientes con LACSCC en el Estudio 1540 requirieron una biopsia para confirmar CR c Basado en la estimación de Kaplan-Meier d El numerador incluye el número de pacientes cuyo DOR observado alcanzó al menos los tiempos especificados de 6 o 12 meses. Los pacientes que no tuvieron la oportunidad de llegar al punto de tiempo especificado se incluyeron solo en el denominador |
Estudio 1423
Entre 26 pacientes con CSCC en el Estudio 1423 16 tenían MCSCC y 10 tenían LACSCC. La mediana de edad fue de 73 años (52 a 88 años); El 81% de los pacientes eran hombres; El 92% de los pacientes eran blancos; El ECOG PS fue 0 (38%) y 1 (62%); El 58% de los pacientes habían recibido al menos 1 terapia sistémica anticancerígena previa; El 92% de los pacientes habían recibido cirugía previa relacionada con el cáncer y el 81% había recibido radioterapia previa. Un paciente en el grupo MCSCC se dosificó a 1 mg/kg. El resto recibió 3 mg/kg cada 2 semanas.
Con una mediana de duración del seguimiento de 13.3 meses, el ORR confirmado fue del 50% (IC 95%: 30 70); Todas las respuestas fueron PRS. La mediana del tiempo de respuesta fue de 1.9 meses (rango: 1.7 a 7.3 meses) y el 85% de los respondedores tuvo un DOR ≥ 6 meses.
Carcinoma de células basales (BCC)
La eficacia de Libtayo en 138 pacientes con carcinoma de células basales avanzadas (BCC) [no resuelto localmente avanzado (LABCC) o metastásico (nodal o distante) (MBCC)] que habían progresado en el inhibidor de la vía de la vía de erizta (HHI) que la terapia no había tenido una respuesta objetiva después de 9 meses en HHI Therapy de HHI. (NCT03132636) Un estudio no aleatorizado de centro múltiple abierto. El estudio excluyó a los pacientes con enfermedad autoinmune que requirieron terapia sistémica con agentes inmunosupresores en 5 años; Historia del trasplante de órganos sólidos; tratamiento previo con terapia anti-PD-1/PD-L1 u otra terapia con inhibidores del punto de control inmune; infección con hepatitis B del VIH o hepatitis C; o puntaje de rendimiento de ECOG (PS) ≥ 2.
Los pacientes recibieron libtayo 350 mg cada 3 semanas durante hasta 93 semanas hasta la progresión de la enfermedad toxicidad inaceptable o finalización del tratamiento planificado. Las evaluaciones tumorales se realizaron cada 9 semanas durante las primeras 45 semanas de tratamiento y cada 12 semanas a partir de entonces. Las principales medidas de resultado de eficacia se confirmaron la tasa de respuesta objetiva (ORR) y la duración de la respuesta (DOR) según lo evaluado por la revisión central independiente (ICR). Para los pacientes con MBCC sin lesiones objetivo visibles externamente, ORR se determinó mediante criterios de evaluación de respuesta en tumores sólidos (Recist 1.1). Para los pacientes con lesiones objetivo visibles externamente (LABCC y MBCC) ORR se determinó mediante un punto final compuesto que integró las evaluaciones de ICR de datos radiológicos (Recist 1.1) y fotografía médica digital (criterios de la OMS).
Se incluyeron un total de 138 pacientes con BCC avanzado en el análisis de eficacia del estudio 1620. De estos 39% tenían MBCC y el 61% tenía LABCC. En pacientes con LABCC, la mediana de edad fue de 70 años (42 a 89 años); 67% eran hombres; El 68% eran blancos y el 32% eran la raza no reportada/desconocida; El 61% tenía ECOG PS 0 y el 39% tenía ECOG PS 1; El 83% había recibido al menos 1 cirugía previa relacionada con el cáncer; y el 50% había recibido radioterapia previa. En pacientes con MBCC, la mediana de edad fue de 63.5 años (38 a 90 años); El 70% eran hombres; El 87% eran blancos y el 13% era raza no reportada/desconocida; El 67% tenía ECOG PS 0 y el 33% tenía ECOG PS 1; El 85% había recibido al menos 1 cirugía previa relacionada con el cáncer; y el 59% había recibido radioterapia previa. Entre los pacientes con MBCC 35% tenían metástasis distantes, solo 9% tenían solo enfermedad ganglionar y el 54% tenía enfermedad distante y ganglia.
Los resultados de eficacia se presentan en la Tabla 11. Para los pacientes que respondieron, el tiempo medio de respuesta fue de 4 meses (rango 2 a 10.5 meses) para el grupo MBCC y 4.3 meses (rango 2.1 a 21.4 meses) para el grupo LABCC.
Tabla 11: Resultados de eficacia para el estudio 1620 en BCC
| Puntos finales de eficaciaa | BCC metastásico | BCC localmente avanzado |
| N = 54 | N = 84 | |
| Tasa de respuesta objetiva confirmada (ORR) (%) | ||
| 22 (12 36) | 32 (22 43) | |
| 1.9 | 7 | |
| 20 | 25 | |
| Duración de la respuesta | ||
| N = 12 | N = 27 | |
| b | 16.7 (9.0 - 25.8) | No (2.1 - 36.8) |
| 12 (100%) | 23 (85%) | |
| CI: intervalo de confianza; NR: No alcanzado; +: Denotes ongoing at last assessment a. Duración mediana del seguimiento: MBCC 8.4 meses; LABCC 15.9 meses b. Basado en la estimación de Kaplan-Meier |
Cáncer de pulmón de células no pequeñas (NSCLC)
Tratamiento de primera línea de NSCLC con incombinación de Libtayo con quimioterapia basada en platino
La eficacia de Libtayo en combinación con la quimioterapia basada en platino se evaluó en el Estudio 16113 (NCT03409614) un ensayo aleatorizado de doble céntrico y doble cenguado controlado en 466 pacientes con CPLC localmente avanzado que no había sido candidatos para la resección quirúrgica o quimoradiación definitiva o con NSCLC Metastástica que no habían recibido previamente el tratamiento de metales. Los pacientes eran elegibles independientemente del estado de expresión tumoral PD-L1.
Pacientes con aberraciones tumorales genómicas EGFR ALK o ROS1; una condición médica que requería inmunosupresión sistémica; o la enfermedad autoinmune continua o reciente que requería la terapia sistémica no era elegible. Los pacientes con antecedentes de metástasis cerebrales eran elegibles si hubieran sido tratados adecuadamente y hubieran regresado neurológicamente al inicio durante al menos 2 semanas antes de la aleatorización.
La aleatorización se estratificó por histología (no escamosa vs escamosa) y la expresión de PD-L1 (<1% versus 1% to 49% versus ≥ 50%) accoding to the VENTANA PD-L1 (SP263) assay. Patients were ryomized (2:1) to receive either:
- Libuta 350 mg intravenously (IV) every 3 weeks fo 108 weeks plus platinum-based quimioterapia every 3 weeks fo 4 cycles o
- Placebo IV cada 3 semanas durante 108 semanas más quimioterapia a base de platino cada 3 semanas durante 4 ciclos.
La quimioterapia basada en platino en cualquier brazo consistió en carboplatino AUC de 5 o 6 y Paclitaxel 200 mg/m2; cisplatin 75 mg/m2 y paclitaxel 200 mg/m2; carboplatino AUC de 5 o 6 y pemetrexed 500 mg/m2; o cisplatin 75 mg/m2 y pemetrexed 500 mg/m2 Mantenimiento Pemetrexed fue obligatorio para pacientes con CPNC no escamoso que recibieron un régimen de quimioterapia que contiene pemetrexed en los primeros 4 ciclos de tratamiento.
El tratamiento del estudio continuó hasta que la enfermedad progresiva definida por RECIST 1.1 defina toxicidad inaceptable o 108 semanas. La evaluación del estado del tumor se realizó cada 9 semanas durante el año 1 y cada 12 semanas después del año 1. La medida de resultado de eficacia principal fue la supervivencia general (SG). Las medidas de resultado de eficacia adicionales fueron la supervivencia libre de progresión (PFS) y la tasa de respuesta general (ORR) según lo evaluado por la revisión central independiente ciego (BICR).
Las características de la población del estudio fueron: edad media de 63 años (rango: 25 a 84) 40% de 65 años o más; 84% hombre; 87% blanco 13% asiático. El quince por ciento tenía el estado de rendimiento del Grupo de Oncología Cooperativa Oriental (ECOG) (PS) 0 y 84% tenían ECOG PS 1; El 85% tenía enfermedad metastásica y el 15% tenía enfermedad de Etapa IIIB o IIIC y no eran candidatos para la resección quirúrgica o quimiorradiación definitiva por evaluación del investigador; El 57% tenía histología no escamosa y 43% tenía histología escamosa; y el 7% tenía antecedentes de metástasis cerebrales tratadas al inicio.
El ensayo demostró una mejora estadísticamente significativa en la SG para pacientes aleatorizados a Libtayo en combinación con quimioterapia en comparación con el placebo en combinación con quimioterapia.
Los resultados de eficacia se presentan en la Tabla 12 y la Figura 1.
Tabla 12: Resultados de eficacia del estudio 16113 en cáncer de pulmón de células no pequeñas
| Puntos finales | Libuta y Quimioterapia N = 312 | Placebo y quimioterapia N = 154 |
| Supervivencia general | ||
| 132 (42) | 82 (53) | |
| a | 21.9 (15.5 NE) | 13.0 (11.9 16.1) |
| b | 0.71 (0.53 0.93) | |
| c | 0.0140 | |
| Supervivencia libre de progresión por BICR | ||
| 204 (65) | 122 (79) | |
| a | 8.2 (6.4 9.3) | 5.0 (4.3 6.2) |
| b | 0.56 (0.44 0.70) | |
| c | <0.0001 | |
| Tasa de respuesta general por BICR (%) | ||
| d | 43 (38 49) | 23 (16 30) |
| 2.6 | 0 | |
| 41 | 23 | |
| c | <0.0001 | |
| Duración de la respuesta per BICR | ||
| a (rango) | 15.6 (1.7 18.7) | 7.3 (1.8 18.8) |
| BICR: revisión central independiente ciego CI: intervalo de confianza; NE: No es evaluable; : Respuesta en curso a Basado en el método de Kaplan-Meier b Basado en el modelo de riesgos proporcionales estratificado c Basado en un valor p de dos lados d Intervalo de confianza exacta de Clopper-Pearson |
Figura 1: Curvas de Kaplan-Meier para OS del estudio 16113
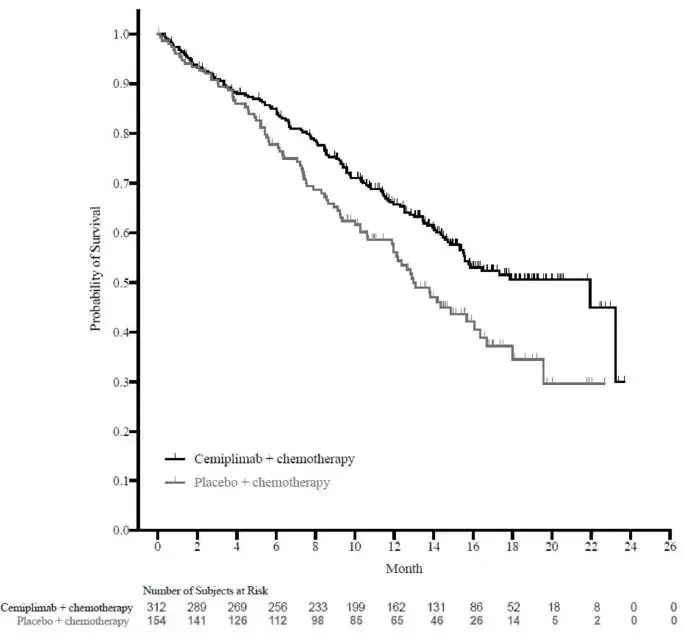 |
Tratamiento de primera línea de NSCLC con Libtayo como agente único
La eficacia de Libtayo se evaluó en el Estudio 1624 (NCT03088540) un ensayo aleatorizado multicéntrico abierto de marca activa abierta en 710 pacientes con CPLC localmente avanzado que no eran candidatos para resección quirúrgica o quimoradiación definitiva o con NSCLC metastásico.
Solo los pacientes cuyos tumores tenían una alta expresión de PD-L1 [puntuación de proporción tumoral (TPS) ≥ 50%] según lo determinado por un ensayo inmunohistoquímico utilizando el kit PD-L1 IHC 22C3 PharmDX y que no había recibido un tratamiento sistémico previo para NSCLC metastásico.
Pacientes con aberraciones tumorales genómicas EGFR ALK o ROS1; una condición médica que requería inmunosupresión sistémica; enfermedad autoinmune que requirió terapia sistémica dentro de los 2 años posteriores al tratamiento; o que nunca habían fumado no eran elegibles. Los pacientes con antecedentes de metástasis cerebrales eran elegibles si hubieran sido tratados adecuadamente y hubieran regresado neurológicamente al inicio durante al menos 2 semanas antes de la aleatorización.
La aleatorización fue estratificada por la histología (no escamosa vs escamosa) y la región geográfica (Europa vs Asia vs Rest of World). Los pacientes fueron asignados al azar (1: 1) para recibir Libtayo 350 mg por vía intravenosa (IV) cada 3 semanas durante hasta 108 semanas o un régimen de quimioterapia de platino y doublet durante 4 a 6 ciclos seguido de un mantenimiento opcional pemetrexed para pacientes con histología no insuficiente que recibieron un régimen de contenido pemetrexed.
El tratamiento con Libtayo continuó hasta que la enfermedad progresiva definida por RECIST 1.1 defina toxicidad inaceptable o hasta 108 semanas. A los pacientes que experimentaron la enfermedad progresiva definida por RECIST 1.1-Terapia de Libtayo se permitieron continuar el tratamiento con Libtayo (hasta 108 semanas adicionales) con la adición de 4 ciclos de quimioterapia específica de histología hasta que se observó una progresión adicional. De los 203 pacientes aleatorizados para recibir quimioterapia que tenían la progresión de la enfermedad definida por RECIST 1.1- La progresión de la enfermedad definida por IRC 150 (74%) los pacientes cruzaron al tratamiento con Libtayo. La evaluación del estado tumoral se realizó cada 9 semanas. Las principales medidas de resultado de eficacia fueron la supervivencia general (SG) y la supervivencia libre de progresión (PFS). Una medida de resultado de eficacia adicional fue la tasa de respuesta general (ORR).
Las características de la población del estudio fueron: edad media de 63 años (rango: 31 a 84) 45% de 65 años o más; 85% hombre; 86% blanco 11% asiático; y 0.6% negro. El nueve por ciento eran hispanos o latinos. El veintisiete por ciento tenía ECOG PS 0 y el 73% tenía ECOG PS 1; El 84% tenía enfermedad metastásica y el 16% tenía enfermedad IIIB o IIIC y no eran candidatos para la resección quirúrgica o quimiorradiación definitiva por evaluación del investigador; El 56% tenía histología no escamosa y 44% tenía histología escamosa; y el 12% tenía antecedentes de metástasis cerebrales tratadas al inicio.
El ensayo demostró una mejora estadísticamente significativa en la SG y la SLP para los pacientes aleatorizados a Libtayo en comparación con la quimioterapia.
Los resultados de eficacia se presentan en la Tabla 13 y la Figura 2.
Tabla 13: Resultados de eficacia del estudio 1624 en cáncer de pulmón de células no pequeñas
| Puntos finales | Libuta N = 356 | Quimioterapia N = 354 |
| Supervivencia general | ||
| 108 (30) | 141 (40) | |
| a | 22.1 (17.7 NE) | 14.3 (11.7 19.2) |
| b | 0.68 (0.53 0.87) | |
| 0.0022 | ||
| Supervivencia libre de progresión por BICR | ||
| 201 (57) | 262 (74) | |
| a | 6.2 (4.5 8.3) | 5.6 (4.5 6.1) |
| b | 0.59 (0.49 0.72) | |
| <0.0001 | ||
| Tasa de respuesta general por BICR (%)c | ||
| 37 (32 42) | 21 (17 25) | |
| 3 | 1 | |
| 33 | 20 | |
| Duración de la respuesta per BICR | ||
| (rango) | 21.0 (1.9 23.3) | 6.0 (1.3 16.5) |
| BICR: revisión central independiente ciego CI: intervalo de confianza; NE: No es evaluable; : Respuesta en curso a. Basado en el método de Kaplan-Meier b. Basado en el modelo de riesgos proporcionales estratificado do. Intervalo de confianza exacta de Clopper-Pearson |
Figura 2: Curva Kaplan-Meier para OS del estudio 1624
 |
Información del paciente para Libtayo
No se proporciona información. Por favor consulte el Advertencias y precauciones sección.












